Đề thi khảo sát chất lượng đầu năm lớp 11 môn Hóa 2025 Có đáp án
Đề kiểm tra chất lượng đầu năm lớp 11 có đáp án
Lớp:
Lớp 11
Môn:
Hóa Học
Dạng tài liệu:
Đề thi
Bộ sách:
Kết nối tri thức với cuộc sống
Loại:
Tài liệu Lẻ
Mức độ:
Trung bình
Loại File:
Word + PDF
Phân loại:
Tài liệu Tính phí
Đề kiểm tra chất lượng đầu năm lớp 11 có đáp án
Đề thi khảo sát chất lượng đầu năm lớp 11 môn Hóa 2025 có đáp án là tài liệu hữu ích giúp học sinh hệ thống lại kiến thức lớp 10 và làm quen với chương trình lớp 11. Bộ đề được biên soạn bám sát cấu trúc, gồm cả trắc nghiệm và tự luận kèm lời giải chi tiết. Với việc luyện tập đề thi khảo sát đầu năm Hóa 11, các em có thể tự đánh giá năng lực, nhận diện điểm mạnh và khắc phục hạn chế để đạt kết quả tốt ngay từ đầu năm học.
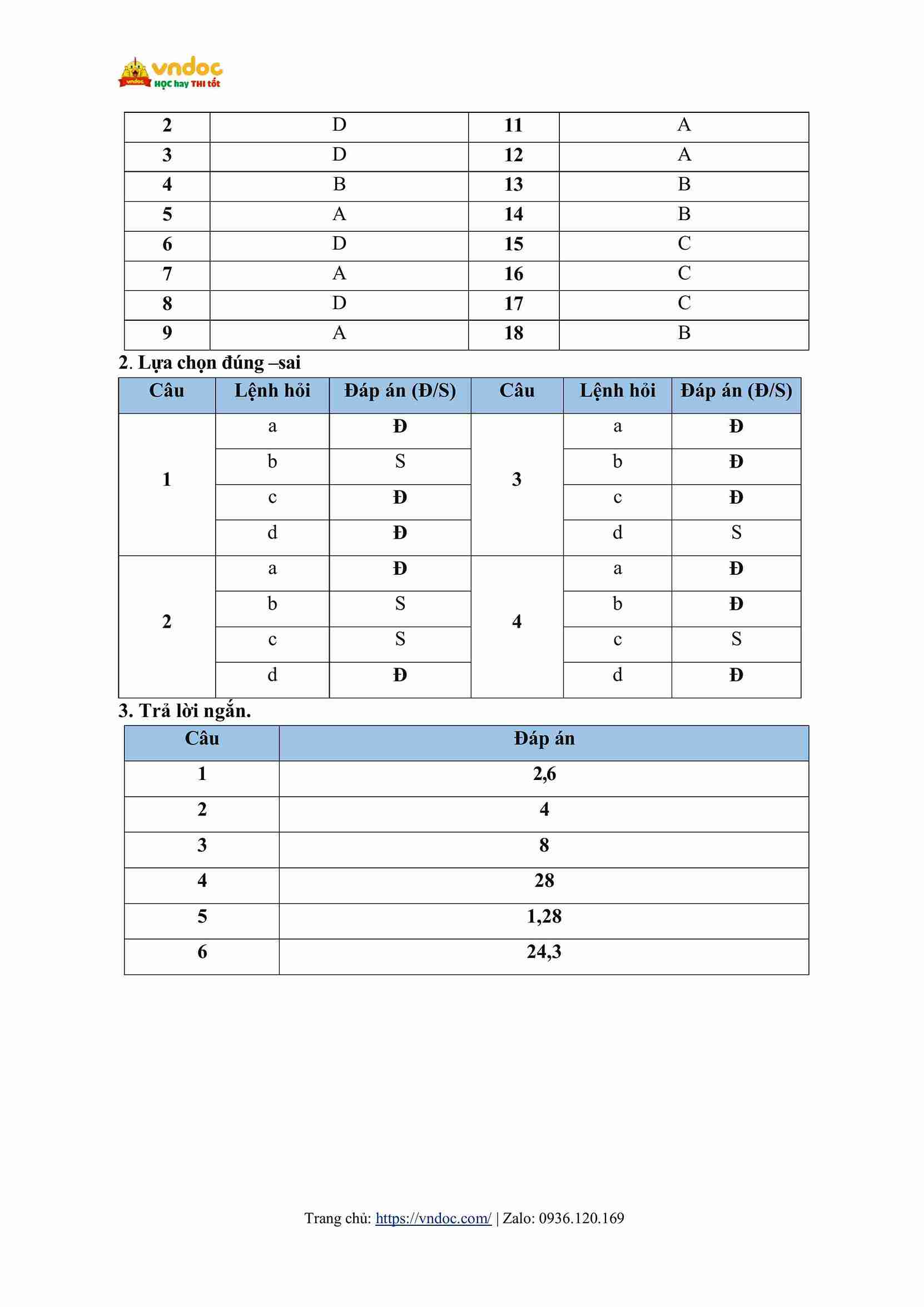
Cấu trúc đề kiểm tra theo CV 7991
- Phần I. Câu trắc nghiệm nhiều phương án lựa chọn. Thí sinh trả lời từ câu 1 đến câu 18. Mỗi câu hỏi thí sinh chỉ chọn một phương án
- Phần II. Câu trắc nghiệm đúng sai. Thí sinh trả lời từ câu 1 đến câu 4. Trong mỗi ý a), b), c), d) ở mỗi câu, thí sinh chọn đúng hoặc sai.
- Phần III. Câu trắc nghiệm yêu cầu trả lời ngắn. Thí sinh trả lời từ câu 1 đến câu 6.