Giải bài tập Hóa 12 nâng cao bài 34
Hóa học 12 - Một số hợp chất quan trọng của nhôm
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa 12 nâng cao bài 34, chắc chắn nội dung tài liệu sẽ là nguồn thông tin hữu ích để phục vụ công việc học tập của các bạn học sinh được tốt hơn. Mời thầy cô và các bạn học sinh cùng tham khảo.
Giải bài tập Hóa 12 nâng cao bài 30
Giải bài tập Hóa 12 nâng cao bài 31
Giải bài tập Hóa 12 nâng cao
Bài 1 (trang 180 sgk Hóa học 12 nâng cao): Hợp chất nào của nhôm tác dụng với dung dịch NaOH (theo tỷ lệ mol 1: 1) có sản phẩm là Na[Al(OH)4]?
Lời giải:
A. Al2(SO4)3
B. AlCl3
C. Al(NO3)3
D. Al(OH)3
Bài 2 (trang 180 sgk Hóa 12 nâng cao): Dãy nào dưới đây gồm các chất vừa tác dụng được với dung dịch axit và dung dịch kiềm?
A. AlCl3 và Al2(SO4)3
B. Al(NO3)3 và Al(OH)3
C. Al2(SO4)3 và Al2O3.
D. Al(OH)3 và Al2O3
Lời giải:
Đáp án D
Bài 3 (trang 180 sgk Hóa 12 nâng cao): Có 3 chất rắn là: Mg, Al2O3, Al. Hãy nhận biết mỗi chất đã cho bằng phương pháp hóa học. Viết các phương trình hóa học.
Lời giải:
Dùng dung dịch NaOH hòa tan 3 mẫu chất rắn
- Nếu là Mg: chất rắn không tan.
- Nếu là Al2O3 chất rẳn tan ra: Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
- Nấu là Al chất rắn tan ra và kèm theo hiện tượng thoát khí
2Al + 2NaOH + 6H2O → 2Na[Al(OH)H4] + 3H2 ↑
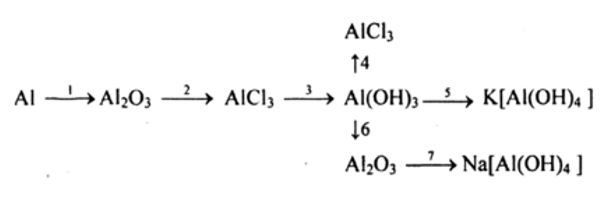
Bài 4 (trang 181 sgk Hóa 12 nâng cao): Viết các phương trình hóa học biểu diễn những chuyển đổi hóa học sau, ghi rõ các diều kiện của phản ứng và cho biết phản ứng nào thuộc loại phản ứng oxi hóa khử.
Lời giải:
Các phương trình hóa học của phản ứng
4Al + 3O2 → Al2O3 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
AlCl3 + 3NaOH → Al(OH)3 + 3NaCl (3)
Al(OH)3 + 3HCl → AlCl + 3H2O (4)
Al(OH)3+ KOH → K[Al(OH)4] (5)
2Al(OH)3 to→ Al2O3 + 3H2O (6)
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (7)
Trong các phản ứng đã cho (1) là phản ứng oxi hóa khử.
Bài 5 (trang 181 sgk Hóa 12 nâng cao): Có các dung dịch AlCl3, HCl, NaOH, H2O và những dụng cụ cần thiết. Hãy điều chế và chứng minh tính lưỡng tính của Al2O3 và Al(OH)3. Viết các phương trình hóa học.
Lời giải:
- Lấy một lượng dung dịch AlCl3 nhỏ từng giọt dung dịch NaOH vào cho tới khi lượng kết tủa không tăng thêm nữa thì dừng.
AlCl + 3NaOH → Al(OH)3+ 3NaCl
Lọc lấy kết tủa, chia làm ba phần.
+ Phần một, chứng minh tính bazơ, tác dụng với dung dịch axit HCl thấy tan ra: Al(OH)3 + 3HCl → AlCl3 + 3H2O
+ Phần hai, chứng minh tính axit, tác dụng với dung dịch NaOH thấy tan ra: Al(OH)3+ KOH → K[Al(OH)4]
+ Phần ba đem nung đến khối lượng không đổi để tạo ra AlO3 rồi chia làm hai phần
Một phần cho tác dụng với axit, một phần cho tác dụng với dung dịch kiềm thấy trong hai trường hợp Al2O3 đều tan => Al2O3 lưỡng tính
Al2O3 + 6HCl → 2AlCl3 + 3H2O
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4]
Bài 6 (trang 181 sgk Hóa 12 nâng cao): Cho 31,2 gam hỗn hợp bột Al và Al2O3 tác dụng với dung dịch NaOH dư, phản ứng xong thu được 13,44 lít khí H2 (đktc). Hãy cho biết:
a. Các phương trình hóa học của các phản ứng đã xảy ra?
b. Khối lượng mỗi chất có trong hỗn hợp ban đầu?
c. Thể tích dung dịch NaOH 4M đã dùng (biết rằng trong thí nghiệm này người ta đã dùng dư 10 cm3 so với thể tích cần dùng).
Lời giải:
a. Phương trình hóa học:
Al2O3 + 2NaOH + 3H2O → 2Na[Al(OH)4] (1)
2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2 ↑ (2)
b, nH2 = 13,44 : 22, 4 = 0,6 mol
Theo pt(2) nAl = 2/3 nH2 = 0,4 mol => nAl = 0,4.27 = 10,8 gam
![]() \(m_{Al_2O_3}\) = 31,2 – 10,8 = 20,4 gam.
\(m_{Al_2O_3}\) = 31,2 – 10,8 = 20,4 gam.
![]() \(n_{Al_2O_3}\) = 0,2 mol
\(n_{Al_2O_3}\) = 0,2 mol
Theo (1) nNaOH = 2![]() \(n_{Al_2O_3}\) = 0,4 mol
\(n_{Al_2O_3}\) = 0,4 mol
Theo (2) nNaOH = nAl = 0,4 mol
=> Tổng số mol NaOH là 0,4 + 0,4 = 0,8 mol
=> VNaOH 4M = 0,8 : 4 = 0,2 lít = 200 cm3
Thể tích dung dịch NaOH đã dùng là: 200 + 10 = 210 cm3
Bài 7 (trang 181 sgk Hóa 12 nâng cao): Cho 150 cm3 dung dịch NaOH 7M tác dụng với l00cm3 dung dịch Al2(SO4)3, 1M. Hãy xác định nồng độ mol của các chất có trong dung dịch sau phản ứng.
Lời giải:
nNaOH = 0,15.7 = 1,05 mol; ![]() \(n_{Al_2(SO_4)_3}\) = 0,1.1 = 0,1 mol
\(n_{Al_2(SO_4)_3}\) = 0,1.1 = 0,1 mol
Al2(SO4)3 + 6NaOH → 2Al(OH)3 + 3Na2SO4
Do NaOH còn dư 1,05 – 0,6 = 0,45 mol nên Al(OH)3 sinh ra bị hòa tan
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau thí nghiệm các chất có trong dung dịch là:
Na2SO4 0,3 mol : Na[Al(OH)4] 0,2 mol; NaOH dư 1,05 – 0,6 – 0,2 = 0,25 mol
Thể tích dung dịch: vdd = 150 + 100 = 250 ml = 0,25 lít
![]() \(C_{MNa_2SO_4}\) = 0,3 : 0,25 = 1,2M
\(C_{MNa_2SO_4}\) = 0,3 : 0,25 = 1,2M
![]() \(C_{MNa[Al(OH)_4]}\) = 0,2 : 0,25 = 0,8 M
\(C_{MNa[Al(OH)_4]}\) = 0,2 : 0,25 = 0,8 M
CMNaOH = 0,25 : 0,25 = 1 M
----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 12 nâng cao bài 34. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12 mà VnDoc tổng hợp và đăng tải.