Giải bài tập Hóa 12 bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại
Giải Hóa 12: Tính chất của kim loại. Dãy điện hóa của kim loại
Giải bài tập Hóa học 12: Tính chất của kim loại. Dãy điện hóa của kim loại vừa được VnDoc.com sưu tập và xin gửi tới bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm 8 bài tập trong sách giáo khoa môn Hóa học lớp 12 bài 18 Tính chất của kim loại. Dãy điện hóa của kim loại. Mời các bạn cùng tham khảo chi tiết và tải về tại đây.
A. Tóm tắt lý thuyết hóa 12 bài 18
I. Tính chất vật lý của kim loại
1. Tính chất vật lý chung
Tính dẻo, Tính dẫn điện, Tính dẫn nhiệt, Tính ánh kim
=> Tính chất vật lí chung của kim loại như nói ở trên gây nên bởi sự có mặt của các electron tự do trong mạng tinh thể kim loại.
2. Tính chất vật lý riêng
Một số tính chất vật lý riêng của kim loại:
+ Tính cứng
+ Nhiệt độ nóng chảy
=> Kim loại dễ nóng chảy nhất là Hg (-39 độ C), khó nóng chảy nhất là W
+ Khối lượng riêng:
Kim loại có khối lượng riêng D < 5 gam/cm3 là kim loại nhẹ (Na, Li, Mg, Al,…)
Kim loại có khối lượng riêng D > 5 gam/cm3 là kim loại nặng.( Cr, Fe, Zn, Pb, Ag, Hg,…)
II. Tính chất hóa học chung của kim loại
Tính chất điển hình của kim loại là tính khử: M → Mn+ + ne
1. Tác dụng với phi kim
a. Tác dụng với clo
Hầu hết các kim loại đều có thể khử trực tiếp clo tạo ra muối clo
2Fe + 3Cl2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
\(\overset{t^{\circ } }{\rightarrow}\) 2FeCl3
b. Tác dụng với oxi
4Al + 3O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
\(\overset{t^{\circ } }{\rightarrow}\) 2Al2O3
c. Tác dụng với lưu huỳnh
Nhiều kim loại có thể khử lưu huỳnh từ xuống . Phản ứng cần đun nóng (trừ Hg).
Ví dụ:
Hg + S → HgS
2. Tác dụng với dung dịch axit
a. Với dung dịch HCl, H2SO4 loãng
Kim loại đứng trước H trong dãy hoạt động hóa học có thể tác dụng được với axit để sinh ra khí H2 bay lên.
b. Với dung dịch HNO3, H2SO4 đặc
KL + (H2SO4 đ, HNO3) → muối + sản phẩm khử (SO2, NO, NO2, H2S ….) + H2O
Chú ý: HNO3, H2SO4 đặc, nguội làm thụ động hoá Al, Fe, Cr, ...
KL sẽ lên số OXH cao nhất khi tác dụng với dung dịch HNO3, H2SO4 đ.
3. Tác dụng với nước
2Na + 2H2O → 2NaOH + H2
4. Tác dụng với dung dịch muối
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag
III. Dãy điện hoá của kim loại
+ Các kim loại trong dãy điện hoá được sắp xếp theo chiều tính khử của kim loại giảm dần và tính oxi hoá của ion kim loại tăng dần.
+ Dãy điện hoá cho phép dự đoán chiều của phản ứng giữa hai cặp oxi hoá - khử: chất oxi hoá mạnh hơn sẽ oxi hoá chất khử mạnh hơn sinh ra chất oxi hoá yếu hơn và chất khử yếu hơn.
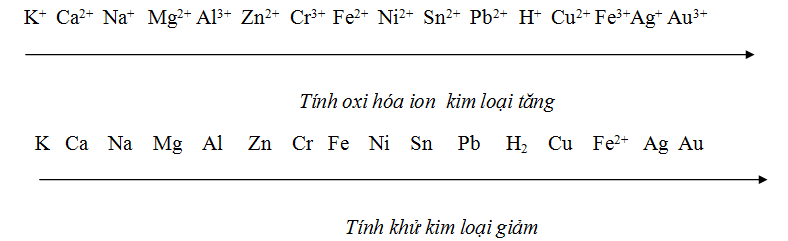
B. Giải bài tập trang 88, 89 SGK Hóa học 12
Bài 1 trang 82 SGK Hóa 12
Giải thích vì sao kim loại đề có tính chất vật lý chung là dẫn điện, dẫn nhiệt, dẻo và ánh kim?
Đáp án hướng dẫn giải bài tập
Tính chất vật lý chung của kim loại có được là do trong cấu tạo mạng tinh thể kim loại có các electron tự do chuyển động trong mạng tinh thể kim loại.
Bài 2 trang 88 SGK Hóa 12
Tính chất hóa học cơ bản của kim loại là gì và vì sao kim loại lại có tính chất đó?
Đáp án hướng dẫn giải bài tập
Tính chất hóa học chung của kim loại là tính khử
M – ne → Mn+
Bởi vì:
Nguyên tử kim loại có số electron hóa trị ít 1,2,3 electron.
Trong cùng một chu kỳ bán kính nguyên tử kim loại lớn, điện tích hạt nhân nhỏ.
Năng lượng ion hóa nguyên tử kim loại nhỏ.
Vì vậy lực liên kết giữa hạt nhân với các electron hóa trị của kim loại là yếu nên chúng dễ tách ra khỏi nguyên tử. Kim loại thể hiện tính khử.
Bài 3 trang 88 SGK Hóa 12
Thủy ngân dễ bay hơi và rất độc. Nếu chẳng may nhiệt kế thủy ngân bị vỡ thì có thể dùng chất nào trong các chất sau để khử độc thủy ngân?
A. Bột sắt.
B. Bột lưu huỳnh.
C. Natri.
D. Nước.
Đáp án hướng dẫn giải bài tập
Đáp án B.
Lưu huỳnh phản ứng được với thủy ngân ở nhiệt độ thường tạo thành muối thủy ngân (II) sunfua kết tủa không độc => loại bỏ được hơi thủy ngân
Hg + S → HgS (không độc)
Bài 4 trang 89 SGK Hóa 12
Dung dịch FeSO4 có lẫn tạp chất là CuSO4. Hãy giới thiệu phương pháp hóa học đơn giản để có thể loại được tạp chất. Giải thích việc làm viết phương trình phản ứng dạng phân tử và ion thu gọn.
Hướng dẫn giải bài tập
Cho một thanh sắt sạch vào dung dịch có phản ứng
Fe + CuSO4 → FeSO4 + Cu
Toàn bộ Cu thoát ra bám trên bề mặt thanh sắt, lấy thanh sắt ra ta còn lại dung dịch chỉ có FeSO4
Fe + CuSO4 → FeSO4 + Cu
Fe + Cu2+→ Fe2++ Cu
Bài 5 trang 9 SGK Hóa 12
Nhúng một lá sắt nhỏ vào dung dịch chứa một trong những chất sau: FeCl3, AlCl3, CuSO4, Pb(NO3)2, NaCl, HCl, HNO3, H2SO4 (đặc nóng), NH4NO3. Số trường hợp phản ứng tạo muối Fe(II) là?
A. 3.
B. 4.
C. 5.
D. 6.
Đáp án hướng dẫn giải bài tập
Chọn B.
Các chất là FeCl3, CuSO4, Pb(NO3)2, HCl
Fe + 2FeCl3 → 3FeCl2
Fe + CuSO4 → FeSO4 + Cu
Fe + Pb(NO3)2 → Fe(NO3)2 + Pb
Fe + 2HCl → FeCl2 + H2
Bài 6 trang 89 SGK Hóa 12
Cho 5,5 gam hỗn hợp Al và Fe (trong đó số mol Al gấp đôi số mol Fe) vào 300 ml dung dịch AgNO3 1M. Khuấy kỹ đến phản ứng hoàn toàn thu m gam chất rắn. Giá trị của m là:
A. 33,95 g
B. 35,2g
C. 39,35g
D. 35,39g
Đáp án hướng dẫn giải bài tập
Các phương trình hóa học có thể xảy ra :
Al + 3Ag+ → Al3+ + 3Ag (1)
Fe + 3Ag+ → Fe3+ + 3Ag (2)
Theo đề bài ta có: 27x + 28x = 5,5 (1) suy ra x = 0,1 mol
Mặt khác số mol AgNO3 = 0,3 x 1 = 0,3 mol , do đó chỉ xảy ra phản ứng (1).
Khối lượng chất rắn = mAg + 5,5 - mAl = 3 x 0,1 x 108 + 5,5 – 2,7 = 35,20 (g)
Đáp án B.
Cách khác
mAl + mFe = 5,5 và nAl = 2nFe
=> nAl = 0,1 ; nFe = 0,05 mol
nAgNO3 = 0,3 mol
Al + 3AgNO3 → Al(NO3)3 + 3Ag
=> chất rắn gồm 0,3 mol Ag và 0,05 mol Fe
=> m = 35,2g
Bài 7 trang 89 SGK Hóa 12
Hãy sắp xếp theo chiều giảm tính khử và chiều tăng tính oxi hoá của các nguyên tử và ion trong hai trường hợp sau đây:
a) Fe, Fe2+, Fe3+, Zn, Zn2+, Ni, Ni2+, H, H+, Hg, Hg2+, Ag, Ag+.
b) Cl, Cl–, Br, Br–, F, F–, I, I–.
Đáp án hướng dẫn giải bài tập
a) Giảm tính khử: Zn > Fe > Ni > H > Hg > Ag
Tăng tính oxi hóa: Zn2+ < Fe2+ < Ni2+ < H+ < Hg2+ < Fe3+ < Ag+
b) Giảm tính khử: I– > Br– > Cl– > F–
Tăng tính oxi hóa: I > Br > Cl > F
Bài 8 trang 89 SGK Hóa 12
Những tính chất vật lý chung của kim loại (dẫn điện, dẫn nhiệt, dẻo, ánh kim) gây ra chủ yếu bởi:
A. Cấu tạo mạng tinh thể của kim loại.
B. Khối lượng riêng của kim loại.
C. Tính chất của kim loại.
D. Các electron tự do trong tinh thể kim loại.
Đáp án hướng dẫn giải bài tập
Những tính chất vật lí chung của kim loại như: tính dẻo, dẫn điện, dẫn nhiệt, ánh kim gây nên chủ yếu bởi các electron tự do trong tinh thể kim loại.
Đáp án D. Các electron tự do trong tinh thể kim loại.
C. Trắc nghiệm Hóa 12 bài 18
-------------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa 12 Bài 18: Tính chất của kim loại. Dãy điện hóa của kim loại. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Hóa học lớp 12
Mời các bạn cùng tham khảo thêm các tài liệu sau:
- Giải bài tập Hóa học 12 bài 14: Vật liệu polime
- Giải bài tập Hóa học 12 bài 15: Luyện tập Polime và vật liệu polime
- Giải bài tập Hóa học 12 bài 16: Thực hành Một số tính chất của protein và vật liệu polime
- Giải bài tập Hóa học 12 bài 17: Vị trí của kim loại trong bảng tuần hoàn và cấu tạo của kim loại
- Giải bài tập Hóa học 12 bài 19: Hợp kim
- Giải bài tập Hóa học 12 bài 20: Sự ăn mòn kim loại
- Giải bài tập Hóa học 12 bài 21: Điều chế kim loại
- Giải bài tập Hóa học 12 bài 22: Luyện tập Tính chất của kim loại










