Giải bài tập Hóa học 11 SBT bài 1
Giải bài tập Hóa học 11 SBT bài Sự điện li
- Bài tập trắc nghiệm 1.1, 1.2 trang 3 sách bài tập (SBT) hóa học 11
- Bài tập 1.3 trang 3 sách bài tập (SBT) hóa học 11
- Bài tập 1.4 trang 3 sách bài tập (SBT) hóa học 11
- Bài tập 1.5 trang 3 sách bài tập (SBT) hóa học 11
- Bài tập 1.6 trang 3 sách bài tập (SBT) hóa học 11
- Bài tập 1.7 trang 4 sách bài tập (SBT) hóa học 11
VnDoc xin giới thiệu tới bạn đọc tài liệu Giải bài tập Hóa học 11 SBT bài 1. Tài liệu gồm 7 bài tập trang 3, 4 kèm theo lời giải chi tiết sẽ giúp các bạn học sinh giải Hoá 11 chính xác nhất. Mời các bạn tham khảo chi tiết bài viết dưới đây nhé.
- Bài tập trắc nghiệm Hóa học lớp 11 chương 1: Sự điện li
- Giải bài tập trang 7 SGK Hóa học lớp 11: Sự điện li
- Bài tập Hóa học lớp 11: Sự điện li
Giải bài tập Hóa học 11 SBT bài Sự điện li vừa được VnDoc.com sưu tập và xin gửi tới bạn đọc cùng tham khảo. Bài viết được tổng hợp gồm có lời giải của 7 bài tập trong sách bài tập môn Hóa học lớp 11. Mời các bạn cùng tham khảo chi tiết và tải về tại đây nhé.
Bài tập trắc nghiệm 1.1, 1.2 trang 3 sách bài tập (SBT) hóa học 11
1.1. Các dung dịch sau đây có cùng nồng độ 0,1 mol/l, dung dịch nào dẫn điện kém nhất?
A. HCl.
B. HF.
C. HI.
D. HBr.
2. Dung dịch nào dưới đây dẫn điện tốt nhất?
A. NaI 2.10−3M.
B. NaI 1.10−2M.
C. NaI 1.10−1M.
D. NaI 1.10−3M.
Hướng dẫn trả lời:
1.1. B
1.2. C
Bài tập 1.3 trang 3 sách bài tập (SBT) hóa học 11
1.3. Giải thích tại sao dung dịch HCl trong nước dẫn điện, còn dung dịch HCl trong benzen không dẫn điện.
Hướng dẫn trả lời:
Dung dịch HCl trong nước chứa các ion H+ và Cl- (do sự phân li của các phân tử HCl) chuyển động tự do, nên dẫn điện.
Dung dịch HCl trong benzen không chứa các ion, vì các phân tử HCl trong dung môi này không phân li ra ion được, nên không dẫn điện.
Bài tập 1.4 trang 3 sách bài tập (SBT) hóa học 11
1.4. Giải thích tại sao khả năng dẫn điện của nước vôi trong (dung dịch Ca(OH)2 trong nước) để trong không khí giảm dần theo thời gian.
Hướng dẫn trả lời:
Vì Ca(OH)2 hấp thụ C02 trong không khí tạo thành kết tủa CaC03 và H20 làm giảm nồng độ các ion trong dung dịch:
Ca2+ + 2OH- + C02 → CaC03↓ + H20(*)
Bài tập 1.5 trang 3 sách bài tập (SBT) hóa học 11
1.5. Viết phương trình điện li của các chất sau trong dung dịch:
1. Các chất điện li mạnh: BeF2, HBr04, K2Cr04.
2. Các chất điện li yếu: HBrO, HCN.
Hướng dẫn trả lời:
1. BeF2 → Be2+ +2F−
HBr04 → H+ + BrO4−
K2Cr04 → 2K+ + CrO42−
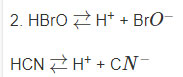
Bài tập 1.6 trang 3 sách bài tập (SBT) hóa học 11
1.6. Viết phương trình điện li của axit yếu CH3COOH trong dung dịch. Nếu hoà tan ít tinh thể chất điện li mạnh CH3COONa vào dung dịch axit trên thì nồng độ H+ tăng hay giảm? Giải thích dựa vào nguyên lí chuyển dịch cân bằng Lơ Satơliê.
Hướng dẫn trả lời:
![]()
CH3COONa phân li trong dung dịch như sau:
CH3COONa → CH3COO− + Na+
Sự phân li của CH3COOH là quá trình thuận nghịch. Đây là cân bằng động. Khi hoà tan CH3COONa vào thì nồng độ CH3COO- tăng lên, làm cho cân bằng (1) chuyển dịch từ phải sang trái, nên nồng độ H+ giảm xuống.
Bài tập 1.7 trang 4 sách bài tập (SBT) hóa học 11
1.7*. Trong dung dịch ![]() \(C{H_3}COOH\) 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l. Hỏi có bao nhiêu phần trăm phân tử
\(C{H_3}COOH\) 4,3.10-2 M, người ta xác định được nồng độ H+ bằng 8,6.10-4 mol/l. Hỏi có bao nhiêu phần trăm phân tử ![]() \(C{H_3}COOH\) trong dung dịch này điện li ra ion?
\(C{H_3}COOH\) trong dung dịch này điện li ra ion?
Hướng dẫn trả lời:
![]()
Nồng độ ban đầu (mol/l): 4,3.10-2 0 0
Nồng độ cân bằng (mol/l): 4,3.10-2-8,6.10-48,6.10-48,6.10-4
Phần trăm phân tử ![]() \(C{H_3}COOH\)phân li ra ion:
\(C{H_3}COOH\)phân li ra ion: ![]() \(\frac{{{{8,6.10}^{ - 4}}}}{{{{4,3.10}^{ - 2}}}}.100\% = 2%.\)
\(\frac{{{{8,6.10}^{ - 4}}}}{{{{4,3.10}^{ - 2}}}}.100\% = 2%.\)
----------------------------------
Trên đây VnDoc.com đã giới thiệu tới bạn đọc tài liệu: Giải bài tập Hóa học 11 SBT bài 1 Sự điện li. Mong rằng qua bài viết này các bạn có thêm tài liệu để học tập tốt hơn môn Hóa học lớp 11 nhé. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Sinh học lớp 11, Vật lý lớp 11, Giải bài tập Hóa học lớp 11, Giải bài tập Toán 11 mà VnDoc tổng hợp và đăng tải.
Mời bạn đọc cùng tham gia nhóm Tài liệu học tập lớp 11 để có thêm tài liệu học tập nhé








