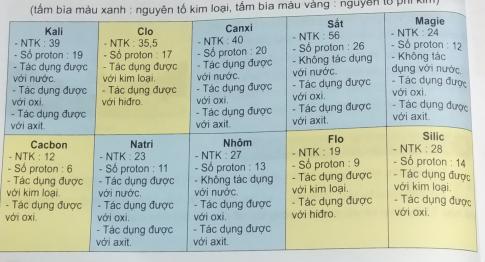
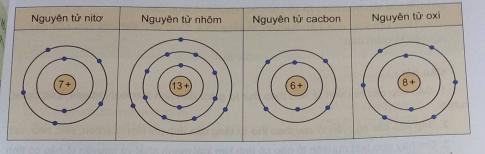
Nhóm 1: Clo, Cacbon, Flo, Silic vì chúng đều là phi kim đều tác dụng với kim loại, tác dụng với hidro.
Nhóm 2: Kali, Canxi, Sắt, Magie, Natri, Nhôm vì chúng đều là kim loại. đều tác dụng với axit, tác dụng với oxi.
B. Hoạt động hình thành kiến thức
I. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Bảng tuần hoàn được xây dựng trên nguyên tắc nào?
Bảng tuần hoàn được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử
Các nguyên tố có cấu hình electron lớp ngoài cùng bằng nhau xếp thành 1 cột (nhóm)
Các nguyên tố có số lớp electron bằng nhau xếp thành 1 hàng (chu kì).
II. Cấu tạo bảng tuần hoàn
1. Ô nguyên tố
Quan sát ô nguyên tố sau và điền vào chỗ trống các cụm từ thích hợp. Cụm từ: số hiệu, kí hiệu, nguyên tố, hạt nhân.
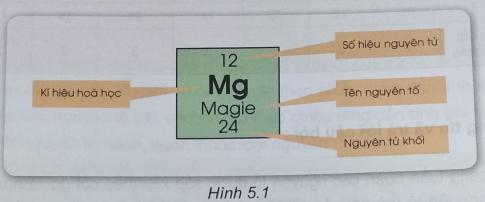
Ô nguyên tố cho biết: ..................... nguyên tử, ................. hóa học, tên ..................... và ...................... khối của .............. đó.
................... nguyên tử (kí hiệu là Z) có số trị bằng số đơn vị điện tích ................ (bằng số proton và bằng số electron trong nguyên tử) và là số thứ tự của ............... trong bảng tuần hoàn.
Ô nguyên tố cho biết: số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố và nguyên tử khối của nguyên tố đó.
Số hiệu nguyên tử (kí hiệu là Z) có số trị bằng số đơn vị điện tích nguyên tử (bằng số proton và bằng số electron trong nguyên tử) và là số thứ tự của nguyên tố trong bảng tuần hoàn.
2. Chu kì
1. Em hãy cho biết nguyên tắc sắp xếp các nguyên tố trong một chu kì.
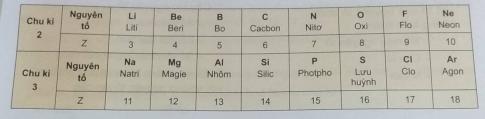
2. Quan sát bảng dưới đây và cho biết chu khì 2 và chu kì 3 gồm những nguyên tố nào?
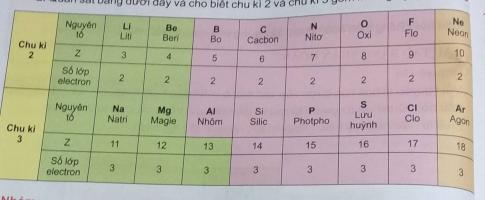
1. Nguyên tắc sắp xếp các nguyên tố trong một chu kì: những nguyên tố có cùng số lớp electron và được sắp xếp theo chiều điện tích hạt nhân tăng dần
2. Chu kì 2: Liti, Beri, Bo, Cacbon, Nito, Oxi, Flo, Neon
Chu kì 3: Natri, Magie, Nhôm, Silic, Photpho, Lưu huỳnh, Clo, Agon