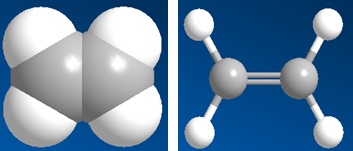
Giống nhau: Đều có phản ứng cháy.
Khác nhau: Etilen và axetilen còn có phản ứng cộng brom đặc trưng và phản ứng trùng hợp. Metan có phản ứng thế clo đặc trưng.
Phương trình hóa học
Phản ứng cháy:
CH4 + 2O2 → CO2 + 2H2
C2H4 + 3O2 → 2CO2 + 2H2O
2C2H2 + 5O2 → 4CO2 + 2H2O
Phản ứng thế clo của metan:
CH4 + Cl2 → HCl + CH3Cl
Phản ứng cộng brom của etilen và axetilen:
C2H4 + 2Br2 → C2H4Br4
C2H2 + 2Br2 → C2H2Br4
Phản ứng trùng hợp:
 \(n_{CH} ≡CH \rightarrow (CH=CH)_n\) (Điều kiện nhiệt độ, áp suất)
\(n_{CH} ≡CH \rightarrow (CH=CH)_n\) (Điều kiện nhiệt độ, áp suất) \(n_{H_2C}=CH_2\rightarrow n_{(CH_2-CH_2)}\)
\(n_{H_2C}=CH_2\rightarrow n_{(CH_2-CH_2)}\)