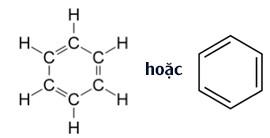
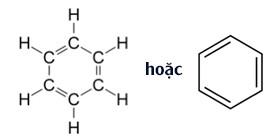
Đáp án: C
Câu 2: Trang 26 khoa học tự nhiên 9 VNEN tập 2
a) Viết PTHH của phản ứng thế giữa benzen với brom. Ghi rõ điều kiện phản ứng.
b) Tính khối lượng của benzen cần dùng để điều chế 31,4 gam brombenzen. Biết hiệu suất của phản ứng đạt 80%.
a) PTHH: ![]() \(C_6H_6 + Br_2 \overset{Fe,t^\circ}{\rightarrow} C_6H_5Br + HBr.\)
\(C_6H_6 + Br_2 \overset{Fe,t^\circ}{\rightarrow} C_6H_5Br + HBr.\)
b) Số mol brombenzen là: ![]() \(n_{C_6H_5Br} = \frac{31,4}{157}\)
\(n_{C_6H_5Br} = \frac{31,4}{157}\)
Theo PTHH, Số mol brom tham gia phản ứng theo lí thuyết là: ![]() \(n_{br_2} = n_{C_6H_5Br} = 0,2 mol\)
\(n_{br_2} = n_{C_6H_5Br} = 0,2 mol\)
Khối lượng brom theo lí thuyết là: ![]() \(m_{lt} = 0,2\times 160 = 32 (gam)\)
\(m_{lt} = 0,2\times 160 = 32 (gam)\)
Khối lượng brom thực tế là: ![]() \(m = m_{lt} : H = 32 : 80\% = 40 (gam)\)
\(m = m_{lt} : H = 32 : 80\% = 40 (gam)\)
Câu 3: Trang 26 khoa học tự nhiên 9 tập 2
Cho các chất sau:
![]() \(CH_2=CH-C\equiv CH;\; CH_3-CH_3;\; CH_3-C\equiv C-CH_3;\)
\(CH_2=CH-C\equiv CH;\; CH_3-CH_3;\; CH_3-C\equiv C-CH_3;\)![]() ;
; ![]()
Chất nào có thể làm mất màu dung dịch brom? Giải thích và viết PTHH (nếu có).