Khoa học tự nhiên 9 bài 6: Ôn tập hóa học vô cơ
Bài 6: Ôn tập hóa học vô cơ
Khoa học tự nhiên 9 bài 6: Ôn tập hóa học vô cơ được VnDoc sưu tầm và đăng tải. Dưới đây là những câu hỏi kèm câu trả lời chi tiết giúp các bạn học sinh dễ hiểu, học tập tốt hơn môn Khoa học tự nhiên lớp 9 này. Mời các bạn cùng tham khảo
- Khoa học tự nhiên 9 tập 1 bài 2: Nhôm
- Khoa học tự nhiên 9 tập 1 bài 3: Sắt, hợp kim của sắt: gang thép
- Khoa học tự nhiên 9 bài 4: Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
- Khoa học tự nhiên 9 bài 5: Sơ lược bảng tuần hoàn các nguyên tố hóa học
1.Viết PTHH của các phản ứng (nếu có) trong các các trường hợp sau:
![]() \(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
\(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
![]() \(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
\(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
![]() \(c, Ca + H_{2}O \rightarrow d, Mg + H_{2}O \rightarrow\)
\(c, Ca + H_{2}O \rightarrow d, Mg + H_{2}O \rightarrow\)
![]() \(e, K_{2}O + H_{2}O \rightarrow\)
\(e, K_{2}O + H_{2}O \rightarrow\)
Bài làm:
![]() \(a, 3H_{2} + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow} 2Fe + 3H_{2}O\)
\(a, 3H_{2} + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow} 2Fe + 3H_{2}O\)
![]() \(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\) Không phản ứng
\(b, H_{2} + Al_{2}O_{3} \overset{t^{o}}{\rightarrow}\) Không phản ứng
![]() \(c, Ca + 2H_{2}O \rightarrow Ca(OH)_{2} + H_{2}\)
\(c, Ca + 2H_{2}O \rightarrow Ca(OH)_{2} + H_{2}\)
![]() \(d, Mg + H_{2}O \rightarrow\) Không phản ứng e,
\(d, Mg + H_{2}O \rightarrow\) Không phản ứng e, ![]() \(K_{2}O + H_{2}O \rightarrow 2KOH\)
\(K_{2}O + H_{2}O \rightarrow 2KOH\)
2. a, Viết PTHH biểu diễn sự chuyển hóa sau đây:
![]() \(S\overset{(1)}{\rightarrow} H_{2}S \overset{(2)}{\rightarrow} Na_{2}S \overset{(3)}{\rightarrow} PbS\)
\(S\overset{(1)}{\rightarrow} H_{2}S \overset{(2)}{\rightarrow} Na_{2}S \overset{(3)}{\rightarrow} PbS\)
b, Viết PTHH của các phản ứng (nếu có) trong các trường hợp sau:
![]() \(1) CO + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
\(1) CO + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
![]() \(2) CO + MgO \overset{t^{o}}{\rightarrow}\)
\(2) CO + MgO \overset{t^{o}}{\rightarrow}\)
![]() \(3) C + PbO \overset{t^{o}}{\rightarrow}\)
\(3) C + PbO \overset{t^{o}}{\rightarrow}\)
![]() \(4) Cl_{2} + H_{2}O \rightleftharpoons\)
\(4) Cl_{2} + H_{2}O \rightleftharpoons\)
![]() \(5) Cl_{2} + NaOH \rightarrow\)
\(5) Cl_{2} + NaOH \rightarrow\)
![]() \(6) Br_{2} + NaI\rightarrow r\)
\(6) Br_{2} + NaI\rightarrow r\)
Bài làm:
a,
![]() \(1) S + H_{2} \overset{t^{o}}{\rightarrow} H_{2}S\)
\(1) S + H_{2} \overset{t^{o}}{\rightarrow} H_{2}S\)
![]() \(2) H_{2}S+ 2NaOH\rightarrow Na_{2}S + 2H_{2}O\)
\(2) H_{2}S+ 2NaOH\rightarrow Na_{2}S + 2H_{2}O\)
![]() \(3) Na_{2}S+ Pb(NO_{3})_{2}\rightarrow PbS + 2NaNO_{3}\)
\(3) Na_{2}S+ Pb(NO_{3})_{2}\rightarrow PbS + 2NaNO_{3}\)
b,
![]() \(1) 3CO + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
\(1) 3CO + Fe_{2}O_{3} \overset{t^{o}}{\rightarrow}\)
![]() \(2 Fe + 3CO_{2} 2) CO + MgO \overset{t^{o}}{\rightarrow}\)
\(2 Fe + 3CO_{2} 2) CO + MgO \overset{t^{o}}{\rightarrow}\)
![]() \(3) C + PbO \overset{t^{o}}{\rightarrow} CO + Pb\)
\(3) C + PbO \overset{t^{o}}{\rightarrow} CO + Pb\)
![]() \(4) Cl_{2} + H_{2}O \rightleftharpoons HCl + HClO\)
\(4) Cl_{2} + H_{2}O \rightleftharpoons HCl + HClO\)
![]() \(5) Cl_{2} + 2NaOH \rightarrow H_{2}O + NaCl + NaClO\)
\(5) Cl_{2} + 2NaOH \rightarrow H_{2}O + NaCl + NaClO\)
![]() \(6) Br_{2} + 2NaI\rightarrow I_{2} + 2NaBr\)
\(6) Br_{2} + 2NaI\rightarrow I_{2} + 2NaBr\)
3. Viết PTHH (lấy ví dụ với các chất cụ thể) theo dãy chuyển hóa sau:
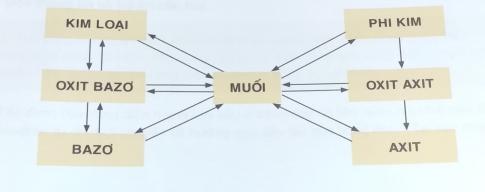
Bài làm:
Vế trái:
![]() \(4Na + O_{2} \overset{t^{o}}{\rightarrow} 2Na_2O\)
\(4Na + O_{2} \overset{t^{o}}{\rightarrow} 2Na_2O\)
![]() \(Na_{2}O + H_{2}O \rightarrow 2NaOH\)
\(Na_{2}O + H_{2}O \rightarrow 2NaOH\)
![]() \(Fe(OH)_{2}\overset{t^{o}}{\rightarrow} FeO + H_{2}O\)
\(Fe(OH)_{2}\overset{t^{o}}{\rightarrow} FeO + H_{2}O\)
![]() \(3CO + Fe_{2}O_{}3 \overset{t^{o}}{\rightarrow} Fe + 3CO_{2}\)
\(3CO + Fe_{2}O_{}3 \overset{t^{o}}{\rightarrow} Fe + 3CO_{2}\)
![]() \(2Al + 6HCl \rightarrow 2AlCl_{3} +3H_{2}\)
\(2Al + 6HCl \rightarrow 2AlCl_{3} +3H_{2}\)
![]() \(Fe + CuSO_{4} \rightarrow FeSO_{4} + Cu\)
\(Fe + CuSO_{4} \rightarrow FeSO_{4} + Cu\)
![]() \(CaO + CO_{2} \rightarrow CaCO_{3}\)
\(CaO + CO_{2} \rightarrow CaCO_{3}\)
![]() \(CaCO_{3} \overset{t^{o}}{\rightarrow} CaO + CO_{2}\)
\(CaCO_{3} \overset{t^{o}}{\rightarrow} CaO + CO_{2}\)
![]() \(NaOH + HCl \rightarrow NaCl + H_{2}O\)
\(NaOH + HCl \rightarrow NaCl + H_{2}O\)
Vế phải:
![]() \(C + O_{2} \overset{t^{o}}{\rightarrow} CO_{2}\)
\(C + O_{2} \overset{t^{o}}{\rightarrow} CO_{2}\)
![]() \(H_{2}O + SO_{3} \rightarrow H_{2}SO_{4}\)
\(H_{2}O + SO_{3} \rightarrow H_{2}SO_{4}\)
![]() \(Br_{2} + 2NaI \rightarrow 2NaBr + I_{2}\)
\(Br_{2} + 2NaI \rightarrow 2NaBr + I_{2}\)
![]() \(Oxit axit \rightleftharpoons\) Muối,
\(Oxit axit \rightleftharpoons\) Muối, ![]() \(axit \rightleftharpoons\) muối tương tự vế trái.
\(axit \rightleftharpoons\) muối tương tự vế trái.
4. a, Em hãy cho biết vị trí của nguyên tố lưu huỳnh trong bảng tuần hoàn các nguyên tố hóa học (ô nguyên tố, chu kì, nhóm).
b, Cho biết tính chất hóa học của lưu huỳnh và so sánh với tính chất hóa học của các nguyên tố: O, P, Se. Giải tích.
Bài làm:
a, Lưu huỳnh (S) có số hiệu nguyên tử là 16. nằm ở ô 16, chu kì 3, nhóm VI.
b, Tính chất hóa học của lưu huỳnh:
- Tác dụng với hidro
- Tác dungnj với phi kim
- Tác dụng với kim loại
- Tác dụng với chất có tính oxi hóa mạnh như: H2SO4 đặc nóng, HNO3 đặc nóng
Tính chất hóa học của S gần tương tự với các nguyên tố O, P, Se. Vì chúng đều là phi kim, nguyên tố O, Se là nguyên tố cùng nhóm với S, còn P là nguyên tố liền trước nó nên chúng có TCHH gần tương tự nhau..
5. Ngâm một lá sắt trong 100 ml dung dịch CuSO4. Sau khi kết thúc phản ứng, lấy lá sắt ra rửa nhẹ, làm khô rồi đem cân, thấy khối lượng lá sắt tăng thêm 0,2 gam so với khối lượng lá sắt ban đầu (giả thiết toàn bộ lượng đồng bám trên lá săt). Xác định nồng độ mol của dung dịch CuSO4 đã dùng.
Bài làm:
Gọi số mol Fe phản ứng là x (mol)
![]() \(Fe + CuSO_{4} \rightarrow FeSO_{4} + Cu\)
\(Fe + CuSO_{4} \rightarrow FeSO_{4} + Cu\)
x x
Thấy 1 lượng sắt mất đi sẽ được bám bởi 1 lượng đồng. Vì khối lượng sắt tăng 0,2g
![]() \(\rightarrow x . (64 - 56) = 0,2 \rightarrow x = 0,025 mol\)
\(\rightarrow x . (64 - 56) = 0,2 \rightarrow x = 0,025 mol\)
![]() \(C_{M CuSO_{4}} = \frac{n}{V}=\frac{0,025}{0,1}=0,25 M\)
\(C_{M CuSO_{4}} = \frac{n}{V}=\frac{0,025}{0,1}=0,25 M\)
6. Hỗn hợp A ở dạng bột gồm Al và Fe. Trộn đều hỗn hợp A rồi chia làm 2 phần bằng nhau.
Cho phần 1 tác dụng với H2SO4 loãng dư thu được 0,784 l khí H2.
Cho phần 2 tác dụng với NaOH dư thu được 0,336 l khí H2
(Biết các phản ứng xảy ra hoàn toàn, các thể tích khí được đo ở đktc). Tính thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp A nói trên.
Bài làm:
Xét phần 2: chỉ có Al tác dụng với NaOH
![]() \(2Al + 2NaOH + 2H_{2}O \rightarrow 2NaAlO_{2} + 3H_{2}\)
\(2Al + 2NaOH + 2H_{2}O \rightarrow 2NaAlO_{2} + 3H_{2}\)
![]() \(x\)
\(x\) ![]() \(\frac{3}{2} x\)
\(\frac{3}{2} x\)
![]() \(n_{H_{2}}= 0,015 mol\)
\(n_{H_{2}}= 0,015 mol\)
![]() \(\rightarrow n_{Al}= 0,015 : \frac{3}{2}=0,01\)
\(\rightarrow n_{Al}= 0,015 : \frac{3}{2}=0,01\)
Xét phần 1: Vì 2 phần bằng nhau nên ![]() \(n_{Alp_1}=n_{Alp_2}=0,01mol\)
\(n_{Alp_1}=n_{Alp_2}=0,01mol\)
![]() \(Fe + H_{2}SO_{4} \rightarrow FeSO_{4} + H_{2}\)
\(Fe + H_{2}SO_{4} \rightarrow FeSO_{4} + H_{2}\)
y y
![]() \(2Al + 3H_{2}SO_{4} \rightarrow Al_{2}(SO_{4})_{3} + 3H_{2}\)
\(2Al + 3H_{2}SO_{4} \rightarrow Al_{2}(SO_{4})_{3} + 3H_{2}\)
0,01 0,015
![]() \(n_{H_{2} p1}= 0,035 mol = 0,015 + y\)
\(n_{H_{2} p1}= 0,035 mol = 0,015 + y\)
![]() \(\rightarrow y = 0,02 (mol)\)
\(\rightarrow y = 0,02 (mol)\)
![]() \(\Rightarrow n_{Al}\) trong
\(\Rightarrow n_{Al}\) trong ![]() \(A=0,02mol\rightarrow m_{Al}\)
\(A=0,02mol\rightarrow m_{Al}\)
![]() \(n_{Fe}\) trong A = 0,04 mol
\(n_{Fe}\) trong A = 0,04 mol ![]() \(\rightarrow m_{Fe}=2,24g\Rightarrow m_A=2,78g\)
\(\rightarrow m_{Fe}=2,24g\Rightarrow m_A=2,78g\)
Vậy ![]() \(\%m_{Al}=\frac{0,54}{2,78}.100\%=19,42\%\)
\(\%m_{Al}=\frac{0,54}{2,78}.100\%=19,42\%\)
![]() \(\%m_{Fe}=100\%-19,42\%=80,58\%\)
\(\%m_{Fe}=100\%-19,42\%=80,58\%\)
7. Từ một tấn quặng hematit chứa 58% Fe2O3 có thể sản xuất được bao nhiêu tấn gang chứa 95,5% sắt. Biết hiệu suất của quá trình sản xuất là 85%.
Bài làm:
Có 1 tấn quặng chứa 580kg Fe2O3
![]() \(3CO+Fe_2O_3\overset{t^{o} }{\rightarrow} Fe+3CO_2\)
\(3CO+Fe_2O_3\overset{t^{o} }{\rightarrow} Fe+3CO_2\)
Tỉ lệ (Kg) 160 2.56
Lí thuyết 580 x
Theo lí thuyết từ 1 tấn quặng hematit có thể sản suất được mFe lí thuyết = ![]() \(\frac{580.2.56}{160}\)= 406 (kg) Mà hiệu suất của quá trình sản xuất là 85%: mFe thực tế = 406 . 85% = 345,1 (Kg)
\(\frac{580.2.56}{160}\)= 406 (kg) Mà hiệu suất của quá trình sản xuất là 85%: mFe thực tế = 406 . 85% = 345,1 (Kg)
⇒ mgang = 345,1 : 95,5% = 361,36 (kg)
............................................
Như vậy VnDoc đã giới thiệu các bạn tài liệu Khoa học tự nhiên 9 bài 6: Ôn tập hóa học vô cơ. Mời các bạn tham khảo thêm tài liệu: Hóa học lớp 9, Giải bài tập Hóa học 9, Giải sách bài tập Hóa 9, Tài liệu học tập lớp 9, ngoài ra các bạn học sinh có thể tham khảo thêm đề học kì 1 lớp 9 và đề thi học kì 2 lớp 9 mới nhất được cập nhật.








