Hóa trị là gì?
VnDoc xin giới thiệu bài Hóa trị là gì? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Câu hỏi: Hóa trị là gì?
Trả lời:
Hóa trị là con số được ký hiệu không phải bằng số tự nhiên, tên chữ số mà là các con số La Mã. Nó được ký hiệu: I, II, III, IV, V, VI, VII. Con số la mã này nói lên được khả năng liên kết của nguyên tử thuộc nguyên tố này với nguyên tử của nguyên tố khác. Giá trị hóa trị được xác định từ số liên kết hóa học mà nguyên tử của nguyên tố đó tạo ra từ phân tử.
1. Hóa trị được xác định như thế nào?
+ Quy ước: Gán cho H hóa trị I , chọn làm đơn vị.
+ Một nguyên tử của nguyên tố khác liên kết với bao nhiêu nguyên tử Hiđro thì nói nguyên tố đó có hóa trị bằng bấy nhiêu.
Ví dụ:
HCl: Cl hóa trị I.
H2O: O hóa trị II
NH3: N hóa trị III
CH4: C hóa trị IV
+ Dựa vào khả năng liên kết của các nguyên tố khác với O.(Hóa trị của oxi bằng 2 đơn vị, Oxi có hóa trị II).
Ví dụ:
K2O: K có hóa trị I.
BaO: Ba có hóa trị II.
SO2: S có hóa trị IV.
- hóa trị của nhóm nguyên tử:
Ví dụ: HNO3: NO3 có hóa trị I.
Vì :Liên kết với 1 nguyên tử H.
H2SO4: SO4 có hóa trị II.
HOH: OH có hóa trị I
H3PO4: PO4 có hóa trị III.
Kết luận : hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
2. Quy tắc hóa trị
Gọi công thức tổng quát của chất gồm 2 nguyên tố là:
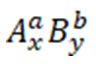
- Trong đó:
+ a, b là hóa trị tương ứng với nguyên tố A và nguyên tố B
+ x, y là chỉ số là số nguyên tử trong hợp chất tương ứng với nguyên tố A và nguyên tố B
- Quy tắc hóa trị trong chương trình hóa học lớp 8 được phát biểu như sau: Trong một công thức hóa học, tích của chỉ số nguyên tử và số hóa trị của nguyên tố này bằng tích của chỉ số nguyên tử và số hóa trị của nguyên tố kia.
- Trong công thức tổng quát ta có: a.x = b.y
- Chúng ta biến đổi tỷ số trên về tối giản nhất đó là chỉ số / hóa trị của nguyên tố chúng ta cần tìm.
- Nếu chúng ta biết công thức hóa học của hợp chất và hóa trị của một nguyên tố hóa học thì chúng ta sẽ tìm được hóa trị của nguyên tố hóa học còn lại. Ngược lại cũng thế, khi chúng ta biết thông tin về hợp chất gồm nguyên tố hóa học tạo nên chất và hóa trị của chất đó hoặc nhóm chất đó thì chúng ta có thể lập được công thức hóa học.
- Quy tắc hóa trị sẽ được áp dụng nhiều trong bài toán lập công thức hóa học của hợp chất khi biết hóa trị và tìm hóa trị của một nguyên tố có trong hợp chất khi đã biết hóa trị của nguyên tố kia. Những dạng bài tập này sẽ không khó trong chương trình hóa học lớp 8 nếu như các em học thuộc được hóa trị của các nguyên tố tại Bảng Hóa Trị và thuộc hóa trị của những nhóm như hóa trị của nhóm OH là I, hóa trị của SO4 là II, hóa trị của NO3 là I, hóa trị của CO3 là II, hóa trị của PO4 là III.
3. Phương pháp giải bài tập
Dạng 1: Tính hóa trị của 1 nguyên tố
* Cần lưu ý một số kiến thức quan trọng sau:
- Hóa trị của nguyên tố (hay nhóm nguyên tử): Là con số biểu thị khả năng liên kết của nguyên tử (hay nhóm nguyên tử).
- Cách xác định hóa trị: xác định theo hóa trị của H được chọn làm một đơn vị và hóa trị của O là hai đơn vị.
- Quy tắc hóa trị: Xét phân tử Aax , Bby
=> Ta có : x. a = y. b

Giải:
- Gọi hóa trị của Fe là a, ta có: 1.a = 3.1 = a = II.
- Tương tự, ta có:
AgCl: 1.a = 1.I = a = I; vậy Ag có hóa trị I
CuC,: 1.a = 2.I = a = II; Vậy Cu có hóa trị II
AICI3: 1.a = 3.I = a = III; Vậy Al có hóa trị II
Dạng 2: Lập công thức hóa học của hợp chất theo hóa trị
- Để lập được CTHH của hợp chất bắt buộc nắm chắc kí hiệu hóa học (KHHH) và hóa trị của các nguyên tố tạo nên hợp chất.
- Có thể làm theo các bước sau:

Chú ý:
- Nếu một nhóm nguyên tử thì xem như là một nguyên tố và lập công thức hóa học như một nguyên tố khác.
- Khi viết hóa trị phải viết số La Mã, còn chỉ số phải là số tự nhiên.
* Ví dụ 1: Lập công thức hóa học của hợp chất tạo bởi lưu huỳnh VI và Oxi
Giải:

* Ví dụ 2: Lập công thức hóa học của hợp chất tạo bởi Kali hóa trị I và nhóm SO4 hóa trị II
Giải:
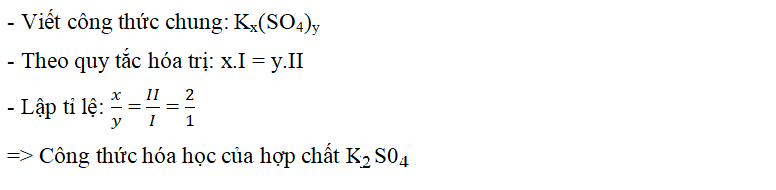
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Hóa trị là gì? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









