Tính chất, công thức hóa học của nhôm sunfat
Tính chất, công thức hóa học của nhôm sunfat được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Tính chất, công thức hóa học của nhôm sunfat
1. Nhôm sunfat là gì?
- Nhôm sunfat là một hợp chất hóa học của nhôm với công thức Al2(SO4)3. Nó hòa tan trong nước và chủ yếu được sử dụng như một chất kết tủa (khiến các hạt ô nhiễm co cụm lại thành các hạt lớn hơn, dễ dàng bị mắc kẹt) trong lọc nước uống và các nhà máy xử lý nước thải, và trong sản xuất giấy.
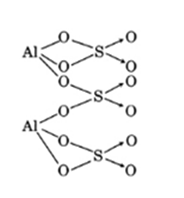
- Công thức phân tử: Al2(SO4)3
- Công thức cấu tạo:
2. Tính chất vật lý, cơ chế tụ keo và nhận biết nhôm sunfat
- Tên khoa học: Kali Alum
- Công thức hóa học của phèn nhôm: KAl(SO4)2.12H2O. Công thức của phèn nhôm có thể hiểu rằng: “K” là một cation hóa trị như Amoni hoặc Kali và “Al” là ion kim loại nhôm có hóa trị ba.
- Khối lượng mol: 258.205 g/mol
- Khối lượng riêng: 1.725 g/cm3
- Tỷ trọng: 1.760 kg/m3
- Nóng chảy ở 92 – 93ºC
- Độ sôi: 200 độ C
- Phân tử gam: 258.207 g/mol
- Độ hòa tan trong nước: 14.00 g/100 mL (20°C); 36.80 g/100 mL (50°C)
- Không tan trong acetone
- Nhận biết: Cho dung dịch nhôm clorua tác dụng với dung dịch BaCl2, thấy xuất hiện kết tủa trắng:
Al2(SO4)3 + 3BaCl2 → 3BaSO4↓ + 2AlCl3
3. Tính chất hóa học của nhôm sunfat
- Mang đầy đủ tính chất hóa học của muối
- Tác dụng với dung dịch bazo:
Al2(SO4)3 + 6KOH(vừa đủ) → 3K2SO4 + 2Al(OH)3
- Tác dụng với dung dịch muối khác:
Al2(SO4)3 + Ba(NO3)2 → 3BaSO4↓ + 2Al(NO3)3
- Phản ứng với kim loại mạnh hơn:
3Mg + Al2(SO4)3 → 3MgSO4 + 2Al
4. Điều chế nhôm sunfat
- Nhôm sunfat Al2(SO4)3 có thể được điều chế bằng cách thêm nhôm hydroxit Al(OH)3 vào trong axit sunfuric. Phương trình phản ứng như sau:
2Al(OH)3 + 3H2SO4 → Al2(SO4)3 + 6H2O
Ngoài ra, nhôm sunfat Al2(SO4)3 cũng có thể được điều chế bằng cách nung nóng kim loại nhôm trong dung dịch H2SO4
2Al(s) + 3 H2SO4→ Al2(SO4)3 + 3H2 (g)
5. Ứng dụng nhôm sunfat
Nhôm sunfat được sử dụng làm chất gắn màu trong quá trình nhuộm. Mordant là một chất hỗ trợ thuốc nhuộm có in trên vải hoặc giấy. Khi trộn với nước, nhôm sunfat tạo ra hydroxyt nhôm giống như bùn giúp hỗ trợ cho hàng dệt với sự hấp thu thuốc nhuộm. Nó cũng làm cho thuốc nhuộm của vải không hòa tan trong nước, do đó vải dệt sẽ không chảy màu. Mặc dù nhôm sunfat đã được sử dụng rất nhiều theo cách này kể từ năm 2000 trước Công nguyên, chỉ có thuốc nhuộm hữu cơ mới yêu cầu chất màu. Thuốc nhuộm tổng hợp hiện đại thì không.
Chất làm đông
Sử dụng công nghiệp lớn nhất của nhôm sulfat là hoạt động như một chất đông tụ trong các nhà máy xử lý nước. Khi xử lý nước thải và nước uống, nó trở thành một yếu tố không thể thiếu của cơ sở hạ tầng hiện đại, nhôm sunfat được sử dụng rất nhiều.
Trong sản xuất giấy
Giống như nhuộm, nhôm sunfat phần lớn đã được thay thế trong quy trình sản xuất giấy bằng cách phát triển hiện đại, nhưng nó vẫn được sử dụng trong bột ban đầu của một số loại giấy. Các hóa chất có tính axit đã được sử dụng để loại bỏ các tạp chất từ nước được sử dụng để làm giấy. Nó cũng được sử dụng trong bột giấy chính nó để giúp ràng buộc vật liệu, trung hòa chi phí và trong kích thước rosin. Mặc dù giấy không có axit, không có Alum đã trở nên phổ biến như một lựa chọn bền hơn, ít có khả năng thay đổi màu sắc.
Ứng dụng khác
Nhôm sulfat cũng đã được sử dụng để giúp kiểm soát sự phát triển tảo trong ao, hồ và đường thủy. Người làm vườn cũng sử dụng hợp chất có tính axit này với cây để điều chỉnh độ pH đặc biệt là đất cơ bản. Nó cũng đã được sử dụng trong bọt chữa cháy, khử mùi, baking soda, làm da, phân bón, xà phòng, thuốc và chất xúc tác hóa học.
Nhôm sunfat được sử dụng rộng rãi trong hóa chất công nghiệp, được biết đến nhiều nhất vì nó sử dụng như một chất làm đông trong xử lý nước
Bài tập 1: Phản ứng hóa học: Al2(SO4)3 + 6KOH → 2Al(OH) ↓ + 3K2SO4 - Cân bằng phương trình hóa học?
Đáp án:
Phản ứng hóa học:
Al2(SO4)3 + 6KOH → 2Al(OH)3↓ + 3K2SO4
Điều kiện phản ứng
- Nhiệt độ phòng
Cách thực hiện phản ứng
- Cho Al2(SO4)3 tác dụng với dung dịch KOH
Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa keo trắng nhôm hidroxit trong dung dịch
Bạn có biết
Các muối tan của nhôm đều tác dụng với dung dịch kiềm vừa đủ tạo kết tủa keo trắng Al(OH)3
Bài tập 2: Cho kim loại nhôm tác dụng với axit sunfuric (H2SO4) tạo ra khí hiđro (H2) và hợp chất nhôm sunfat Al2(SO4)3 , Phương trình hóa học của phản ứng là
- 2Al + 3H2SO4→ Al2(SO4)3+ 3H2
- 2Al + 2H2SO4à Al2(SO4)3+ H2
- 2Al + H2SO4 → Al2(SO4)3 + H2
- 3AI + 3H2SO4→ Al2(SO4)3+ 3H2
Đáp án đúng: A. 2Al + 3H2SO→ Al2(SO4)3 + 3H2
Giải thích:
Sơ đồ phản ứng: Al + H2SO4 ---> Al2(SO4)3 + H2
Nhận thấy bên phải có 3 nhóm SO4 => bên phải cũng phải có 3 nhóm SO4 => cần thêm 3 trước H2SO4
Al + 3H2SO4 ---> Al2(SO4)3 + H2
Ở bên trái có 3H2 và 2 nguyên tử Al => ở bên phải thêm 3 trước H2 và thêm 2 trước Al
=> phương trình hóa học: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Đáp án cần chọn là: A
Bài tập 3: Phản ứng hóa học: Al (SO4)3 + 6NaOH → 2Al(OH)3 ↓ + 3Na2SO4 - Cân bằng phương trình hóa học?
Đáp án:
Phản ứng hóa học:
Al2(SO4)3 + 6NaOH → 2Al(OH)3↓ + 3Na2SO4
Điều kiện phản ứng
- Nhiệt độ phòng
Cách thực hiện phản ứng
- Cho Al2(SO4)3 tác dụng với dung dịch NaOH
Hiện tượng nhận biết phản ứng
- Xuất hiện kết tủa keo trắng nhôm hidroxit trong dung dịch
Bạn có biết
Các muối tan của nhôm đều tác dụng với dung dịch kiềm vừa đủ tạo kết tủa keo trắng Al(OH)3
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Tính chất, công thức hóa học của nhôm sunfat. Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8