Cu(OH)2 kết tủa màu gì, Copper (II) hydroxide) màu gì, Cu(OH)2 có tan không?
VnDoc xin giới thiệu bài Cu(OH)2 kết tủa màu gì, Đồng (II) hidroxit màu gì, Cu(OH)2 có tan không? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cu(OH)2 kết tủa màu gì, Đồng (II) hidroxit màu gì, Cu(OH)2 có tan không?
Câu hỏi: Cu(OH)2 kết tủa màu gì, Đồng (II) hidroxit màu gì, Cu(OH)2 có tan không?
Lời giải:
Cu(OH)2 kết tủa có màu gì?
Đồng(II) hiđrôxit là một hợp chất vô cơ thuộc phân loại bazơ. Đồng(II) hiđrôxit có công thức hóa học là Cu(OH)2 không tan trong nước nhưng tan được trong dung dịch axit, dung dịch NH3 đậm đặc và chỉ tan được trong dung dịch Na(OH) trên 40% và đun nóng.
Đồng(II) hiđrôxit được kết hợp bởi ion Cu2+ và hidroxit (OH-). Phương trình ion như sau:
Cu2+ + OH- = Cu(OH)2
Kết luận: Cu(OH)2 có màu xanh lơ.
Cu(OH)2 có thể tan được trong dd NaOH đặc dư
Cu(OH)2 + NaOH → Na2CuO2 + H2O
Nếu kết tủa để lâu trong không khí sẽ chuyển sang màu đen
Cu(OH)2 → CuO + H2O
Nhận biết:
- Thuốc thử: Dung dịch HCl
- Hiện tượng: thấy chất rắn Cu(OH)2 tan dần, cho dung dịch màu xanh lam.
- Phương trình hóa học: Cu(OH)2 + 2HCl → CuCl2 + 2H2O
- Phương trình ion rút gọn: Cu(OH)2 + 2H+ → Cu2+ + 2H2O
1. Định nghĩa
- Định nghĩa: Đồng(II) hiđrôxit là một hợp chất có công thức hóa học là Cu(OH)2. Nó là một chất rắn có màu xanh lơ, không tan trong nước nhưng dễ tan trong dung dịch axit, amoniac đặc và chỉ tan trong dung dịch NaOH 40% khi đun nóng.
- Công thức phân tử: Cu(OH)2
- Công thức cấu tạo: HO – Cu- OH
2. Tính chất vật lí và nhận biết
- Tính chất vật lí: Là chất rắn có màu xanh lơ, không tan trong nước.
- Nhận biết: Hòa tan vào dung dịch axit HCl, thấy chất rắn tan dần, cho dung dịch có màu xanh lam.
Cu(OH)2 + 2HCl→ CuCl2 + 2H2O
3. Tính chất hóa học
- Có đầy đủ tính chất hóa học của hidroxit không tan.
Tác dụng với axit:
Cu(OH)2 + H2SO4 → CuSO4 + 2H2O
Phản ứng nhiệt phân:
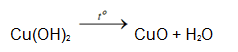
Tạo phức chất, hòa tan trong dung dịch amoniac:
Cu(OH)2 + NH3 → [Cu(NH3)4]2+ + 2OH-
Tạo phức chất, hòa tan trong ancol đa chức có nhiều nhóm –OH liền kề
Cu(OH)2 + 2C3H5(OH)3 → [C3H5(OH)2O]2Cu + 2H2O
Phản ứng với anđehit
![]()
Phản ứng màu biure
- Trong môi trường kiềm, peptit tác dụng với Cu(OH)2 cho hợp chất màu tím. Đó là màu của phức chất tạo thành giữa peptit có từ hai liên kết peptit trở lên tác dụng với ion đồng.
4. Điều chế
- Điều chế Cu(OH)2 bằng cách cho muối Cu (II) tác dụng với dung dịch bazo:
Cu2+ + 2OH- →Cu(OH)2
CuCl2 + 2NaOH →Cu(OH)2 + 2NaCl
5. Ứng dụng
- Dung dịch đồng(II) hiđroxit trong amoniac, có khả năng hòa tan xenlulozo. Tính chất này khiến dung dịch này được dùng trong quá trình sản xuất rayon,.
- Được sử dụng rộng rãi trong ngành công nghiệp thủy sinh vì khả năng tiêu diệt các ký sinh bên ngoài trên cá, bao gồm sán, cá biển, mà không giết chết cá.
- Đồng(II) hiđroxit đã được sử dụng như là một sự thay thế cho hỗn hợp Bordeaux, một thuốc diệt nấm và nematicide.
- Các sản phẩm như Kocide 3000, sản xuất bởi Kocide L.L.C. Đồng (II) hydroxit cũng đôi khi được sử dụng như chất màu gốm.








