KClO3 là gì?
VnDoc xin giới thiệu bài KClO3 là gì? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
KClO3 là gì?
Câu hỏi: KClO3 là gì?
Trả lời:
KClO3 là một hợp chất vô cơ, đây là muối của axit cloric hay còn gọi với lên Kali clorat. Là một trong những hợp chất oxy hóa mạnh; tác dụng được với nhiều kim loại và phi kim khác như: cacbon (C), photpho(P), lưu huỳnh (S), magie (Mg) …..
1. KClO3 là gì?
KClO3 là một hợp chất vô cơ, đây là muối của axit cloric hay còn gọi với lên Kali clorat. Là một trong những hợp chất oxy hóa mạnh; tác dụng được với nhiều kim loại và phi kim khác như: cacbon( C), photpho(P), lưu huỳnh(S), magie (Mg) …..
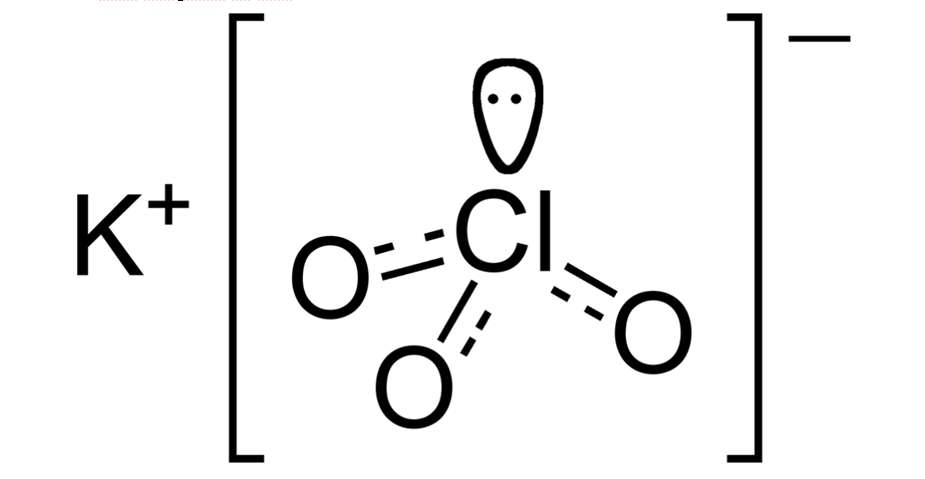
2. Cấu tạo phân tử của KClO3
3. Tính chất vật lý của kali clorat
- Ở dạng tinh thể có màu trắng hoặc không màu
- Tan nhiều trong nước nóng nhưng ít tan trong nước lạnh và không tan trong cồn tuyệt đối
- Khối lượng mol: 122,5492 g/mol
- Khối lượng riêng: 2.32 g/cm3
- Điểm nóng chảy: 356°C (629 K, 673°F)
- Điểm sôi: 400°C (673 K, 752°F)
- Độ hòa tan trong nước: 3.13 g/100ml (ở 0°C), 8.15 g/100ml (ở 25°C), 53.51 g/100ml (ở 100°C), 2930 g/100ml (330°C)
- Độ hòa tan trong Glycerol: 1 g/100 g (20℃)
- Cấu trúc tinh thể: Đơn nghiêng
- Entanpi hình thành ΔfHo298: -391,2 kJ/mol
- Entropy mol tiêu chuẩn So298: 142,97 J/mol·K
- Nhiệt dung: 100,25 J/mol·K
- Chỉ dẫn R: R9 (Nổ khi tạo hỗn hợp với vật liệu dễ bắt lửa), R20/22 (Nguy hiểm khi hít/ nuốt vào.), R51/53 (Độc với thủy sinh vật và môi trường)
- Chỉ dẫn S: S2 (Tránh xa tầm tay trẻ em), S13 (Tránh xa thực phẩm, đồ uống và thực ăn cho động vật), S16 (Để xa nguồn đánh lửa - Không hút thuốc), S27 (Cởi ngay lập tức tất cả các quần áo bị ô nhiễm), S61 (Tránh đưa chất này vào môi trường. Hãy tham khảo các hướng dẫn an toàn)
4. Tính chất hóa học của kali clorat
Là một chất oxy hóa mạnh, có thể tác dụng với nhiều phi kim và kim loại như cacbon, photpho, nhôm, lưu huỳnh, magie,…
2KClO3 + 3S → 2KCl + 3SO2
KClO3 + 3Mg → KCl + 3MgO
5KClO3 + 6P → 5KCl + 3P2O5
Các phương trình phản ứng khác:
KClO3 + 6HCl → 3Cl2 + KCl + 3H2O
2KClO3 + 3MnO2 → 2KMnO4 + MnCl2 + 2O2
KClO3 + 3H2 → KCl + 3H2O
5. Điều chế kali clorat như thế nào?
Có nhiều cách để điều chế Kali Clorat, cụ thể là:
Đun nóng Canxi Clorat với muối Kali Clorua ở nhiệt độ 70 – 75 °C
2KCl + Ca(ClO3)2 ⟶ 2KClO3 + CaCl2
Cho Kali Clorua tác dụng với Natri Clorat ở điều kiện thường
KCl + NaClO3 ⟶ KClO3 + NaCl
Điện phân dung dịch Kali Cloria không vách ngăn trong điều kiện nhiệt độ 70°C. Phản ứng sẽ làm bọt khí H2 xuất hiện.
H2O + KCl ⟶ H2 + KClO3
Cho Bari Clorat tác dụng với Kali iodat ở điều kiện thường. Phản ứng xảy ra như sau:
Ba(ClO3)2 + 2KIO3 ⟶ 2KClO3 + Ba(IO3)2
Nhiệt phân Kali hypoclorit trong điều kiện nhiệt độ 70°C. Phản ứng xảy ra như sau:
3KClO ⟶ 3KCl + KClO3
6. Ứng dụng của Kali clorat – KClO3
- Được trộn lẫn với nhiều loại vật liệu dễ cháy như lưu huỳnh, photpho, bột kim loại,… để chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ..
- Dùng để sản xuất diêm: Thuốc ở đầu que diêm thường chứa gần 50% Kali Clrorat.
- Điều chế oxy trong phòng thí nghiệm bằng cách nhiệt phân KClO3 với xúc tác là MnO2.
- Dùng làm chất khử màu trong dệt nhuộm và chất chống oxy hóa.
- Kali Clorat là một chất có tính oxy hóa rất mạnh, khi bị oxy hóa sẽ giải phóng khí oxy nên nó có thể dùng như một chất diệt cỏ.
- Tại Việt Nam, muối Kali Clorat được sử dụng như một chất điều hòa cây trồng trong nông nghiệp.
Cho Kali hydroxit KOH tác dụng với khí Clo ở nhiệt độ trên 80 độ C. Phản ứng xảy ra như sau:
3Cl2 + 6KOH ⟶ 3H2O + 5KCl + KClO3
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu KClO3 là gì? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









