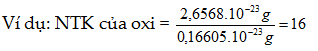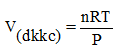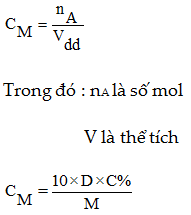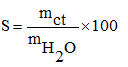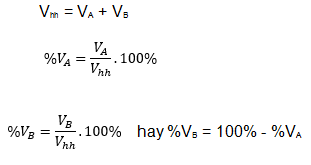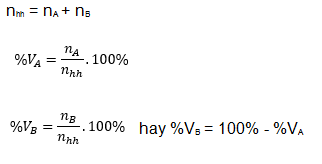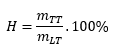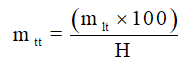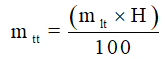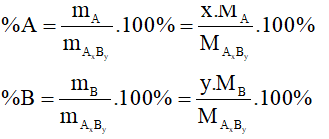Các công thức hóa học lớp 8
Các công thức hóa học lớp 8 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Các công thức hóa học lớp 8
- 1. Cách tính nguyên tử khối
- 2. Định luật bảo toàn khối lượng
- 3. Công thức tính tỉ khối
- 4. Công thức tính thể tích
- 5. Nồng độ phần trăm
- 6. Nồng độ mol
- 7. Độ tan
- 8. Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp
- 9. Công thức tính hiệu suất phản ứng (H; đơn vị: %)
- 10. Công thức tính khối lượng chất tham gia khi có hiệu suất
- 11. Công thức tính khối lượng sản phẩm khi có hiệu suất
- 12. Tính thành phần phần trăm về khối lượng của nguyên tố trong hợp chất
- 13. Bài toán về lượng chất dư
1. Cách tính nguyên tử khối
NTK của A = Khối lượng của nguyên tử A tính bằng gam: khối lượng của 1 đvC tính ra gam
2. Định luật bảo toàn khối lượng
Cho phản ứng: A + B → C + D
Áp dụng định luật BTKL:
mA + mB = mC + mD
3. Công thức tính tỉ khối
- Công thức tính tỉ khối của khí A với khí B:
- Công thức tính tỉ khối của khí A đối với không khí:
Trong đó D là khối lượng riêng: D(g/cm3) có m (g) và V (cm3) hay ml
4. Công thức tính thể tích
- Thể tích chất khí ở đktc
V = n x 22,4
- Thể tích của chất rắn và chất lỏng
- Thể tích ở điều kiện không tiêu chuẩn
P: áp suất (atm)
R: hằng số (22,4:273)
T: nhiệt độ: oK (oC+ 273)
5. Nồng độ phần trăm
6. Nồng độ mol
C%: nồng độ mol
D: Khối lượng riêng (g/ml)
M: Khối lượng mol (g/mol)
7. Độ tan
8. Công thức tính thành phần phần trăm về thể tích các chất trong hỗn hợp
Giả sử hỗn hợp gồm hai chất A và B
Lưu ý:
- Vhh; VA; VB lần lượt là thể tích hỗn hợp, thể tích chất A, thể tích chất B.
- Với các chất khí ở cùng điều kiện, thì điều kiện về thể tích cũng chính là tỉ lệ về số mol, nên có thể tính như sau:
-Với nhh; nA; nB lần lượt là số mol hỗn hợp, số mol chất A, số mol chất B.
9. Công thức tính hiệu suất phản ứng (H; đơn vị: %)
- Tính theo khối lượng chất sản phẩm:
Lưu ý:
mTT: khối lượng sản phẩm thực tế;
mLT: khối lượng sản phẩm theo lý thuyết;
mTT và mLT trong công thức phải có cùng đơn vị.
- Tính theo số mol chất tham gia:
Lưu ý:
npư: số mol chất tham gia đã phản ứng.
nbđ: số mol chất tham gia ban đầu.
10. Công thức tính khối lượng chất tham gia khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng chất tham gia thực tế đem vào phản ứng phải hơn nhiều so với lý thuyết để bù vào sự hao hụt. Sau khi tính khối lượng chất tham gia theo phương trình phản ứng, ta có khối lượng chất tham gia khi có hiệu suất như sau:
11. Công thức tính khối lượng sản phẩm khi có hiệu suất
Do hiệu suất phản ứng nhỏ hơn 100%, nên lượng sản phẩm thực tế thu được phải nhỏ hơn so với lý thuyết. Sau khi khối lượng sản phẩm theo phương trình phản ứng, ta tính khối lượng sản phẩm khi có hiệu suất như sau:
12. Tính thành phần phần trăm về khối lượng của nguyên tố trong hợp chất
Giả sử có công thức hóa học đã biết AxBy, ta tính được %A; %B
13. Bài toán về lượng chất dư
Giả sử có phản ứng hóa học: aA + bB ------- > cC + dD.
Cho nA là số mol chất A, và nB là số mol chất B
Tính lượng các chất theo chất phản ứng hết.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Các công thức hóa học lớp 8 Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8