Nêu công thức tính tỉ khối của chất khí?
VnDoc xin giới thiệu bài Nêu công thức tính tỉ khối của chất khí? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Công thức tính tỉ khối của chất khí
Câu hỏi: Nêu công thức tính tỉ khối của chất khí?
Trả lời:
Công thức tính tỉ khối của chất khí:
- Tỉ khối của khí A đối với khí B:
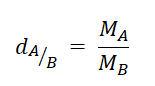
Trong đó:
+ d(A / B) là tỉ khối của khí A đối với khí B
+ MA là khối lượng mol khí A
+ MB là khối lượng mol khí B.
Khi: d(A / B) > 1 ⇒ khí A nặng hơn khí B
d(A / B) = 1 ⇒ khí A nặng bằng khí B
d(A / B) < 1 ⇒ khí A nhẹ hơn khí B.
- Tỉ khối của khí A với không khí:
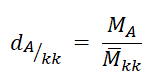
Trong đó:
+ d (A / kk) là tỉ khối của khí A đối với không khí.
+ MA là khối lượng mol khí A
+ Mkk là khối lượng mol không khí ( = 29 g/mol)
Khi: d (A / kk) > 1 ⇒ khí A nặng hơn không khí.
d (A / kk) = 1 ⇒ khí A nặng bằng không khí.
d (A / kk) < 1 ⇒ khí A nhẹ hơn không khí.
Ví dụ:
a) Khí nitơ nặng hơn hay nhẹ hơn khí hiđro?
b) Khí CO2nặng hơn hay nhẹ hơn không khí?
Giải
a) Tính tỉ khối của khí nitơ đối với khí hiđro:
Khối lượng mol phân tử khí nitơ: MN2 = 28 g/mol
Khối lượng mol phân tử khí hiđro: MH2 = 2 g/mol
Ta có:
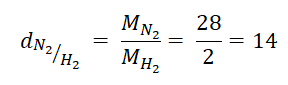
→ Khí nitơ nặng hơn khí hiđro 14 lần.
b) Tính tỉ khối của khí CO2 đối với không khí:
Khối lượng mol phân tử khí CO2: MCO2 = 44 g/mol
Ta có:
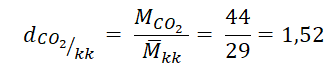
→ Khí CO2 nặng hơn không khí 1,52 lần.
I. Tỉ khối chất khí là gì?
Tỉ khối chất khí là tỉ số khối lượng giữa chất A và chất B dùng để so sánh chất A nặng hơn hay nhẹ hơn chất B và nặng hơn hay nhẹ hơn bao nhiêu lần.
Lưu ý: Chất ở đây các em có thể hiểu là đơn chất như H2, O2, N2, Cl2... hoặc hỗn hợp các chất [N2, O2] với [Cl2] hoặc [NO2, N2] với [O2]...
II. Công thức tính tỉ khối
Tỉ khối của chất khí A đối với khí B là tỉ lệ về khối lượng mol của khí A (MA) với khối lượng mol của khí B (MB). Dựa vào tỉ khối có thể biết được một chất khí nặng hay nhẹ hơn chất khí khác.
dA/B = MA/MB
Trong đó:
+ dA/B: tỉ khối của khí A đối với khí B
+ MA, MB: lần lượt là khối lượng mol của khí A và khí B
Xảy ra các trường hợp:
+ Nếu dA/B >1 => Khí A nặng hơn khí B
+ Nếu dA/B = 1 => Khí A nặng bằng khí B
+ Nếu dA/B < 1> Khí A nhẹ hơn khí B
Ví dụ: Khí Oxi nặng hay nhẹ hơn khí nito bao nhiêu lần?
Ta có: dO2/N2 = MO2/MN2 = 32/28 ≈ 1,14 ⇒ Khí oxi nặng hơn khí nito 1,14 lần.
Khí cacbonic nặng hay nhẹ hơn khí hidro bao nhiêu lần?
Ta có: dCO2/H2 = MCO2/MH2 = 44/2 = 22 ⇒ Khí cacbonic nặng hơn khí hidro 2 lần.
III. Bài tập tự luyện
Bài 1: B là oxit của nitơ có tỷ khối hơi so với khí cacbonic (CO2) là 1. B có công thức phân tử là:
- NO2
- N2O
- N2O4
- NO
Đáp án cần chọn là: B. N2O
Bài 2: Hỗn hợp khí CO và CO2 có tỉ khối so với O2 là 1. Thể tích khí CO2 cần thêm vào 8,96 lít hỗn hợp trên (đktc) để có tỉ khối so với O2 tăng lên bằng 1,075 là:
- 2,24 lít
- 1,12 lít
- 11,2 lít
- 22,4 lít
Đáp án cần chọn là: A. 2,24 lít
Bài 3: Hỗn hợp khí SO2 và O2 có tỉ khối so với CH4 là 3. Thể tích khí O2 cần thêm vào 4,48 lít hỗn hợp trên (đktc) để có tỉ khối so với CH4 giảm còn 2,8 là:
- 2,24 lít
- 1,12 lít
- 11,2 lít
- 22,4 lít
Đáp án cần chọn là: B. 1,12 lít
Bài 4: Cho các khí sau: Cl2; H2; O2; SO3; CH4; CO2. Số lượng khí có thể thu được bằng cách đẩy nước trong phòng thí nghiệm là:
- 4
- 3
- 5
- 2
Lời giải:
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước
Khí có thể thu được bằng cách đẩy nước trong phòng thí nghiệm là: H2; O2; CH4; CO2.
Đáp án cần chọn là: A. 4
Bài 5: Cho hình vẽ về cách thu khí dời nước như sau: Hình vẽ bên có thể áp dụng để thu được khí nào trong các khí sau đây?
- H2, HCl, H2S
- H2, CO2
- NH3, HCl
- H2, NH3
Lời giải:
Khí thu bằng phương pháp đẩy nước phải chọn những khí ít hoặc không tan trong nước
→ chọn B có CO2 ít tan trong nước và H2 không tan trong nước
Đáp án cần chọn là: B. H2, CO2
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Nêu công thức tính tỉ khối của chất khí? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









