Cách giải bài toán dư Hóa học 8
Cách giải bài toán dư Hóa học 8 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cách giải bài toán dư
1. Dạng bài có lượng chất dư
Bài toán cho biết lượng của hai chất tham gia và yêu cầu tính lượng chất tạo thành. Trong số hai chất tham gia phản ứng sẽ có một chất phản ứng hết, chất kia có thể phản ứng hết hoặc dư.
Lượng chất tạo thành tính theo lượng chất nào phản ứng hết, do vậy trước khi làm bài cần phải tìm xem trong hai chất đã cho, chất nào phản ứng hết.
2. Phương pháp giải bài toán có lượng chất dư
Giả sử có phản ứng hóa học: aA + bB → cC + dD.
Cho nA là số mol chất A, và nB là số mol chất B

Tính lượng các chất theo chất phản ứng hết.
* Các bước giải:
- B1: Đổi dữ kiện đầu bài ra số mol
- B2: Viết phương trình phản ứng
- B3: Dựa vào phương trình phản ứng và tỉ lệ, tìm tỉ lệ số mol và hệ số phản ứng của 2 chất tham gia theo PTHH
- B4: Vậy tính toán dựa vào số mol chất phản ứng hết, điền số mol chất hết lên PTHH.
Từ các dữ kiện có liên quan tìm được số mol của các chất theo yêu cầu đề bài.
* Cách khác: Giả sử tính theo chất A. Từ nA tính ra nB.
+) Nếu nB tính toán = nB thực tế => Cả 2 chất đều hết
+) Nếu nB tính toán > nB thực tế=> vô lí bài toán tính theo B
+) Ngược lại nếu số mol nB tính toán <nB thực tế => B dư giả sửa đúng.
3. Ví dụ minh họa
Ví dụ 1. Khi cho miếng nhôm tan hết vào dung dịch HCl có chứa 0,2 mol thì sinh ra 1,12 lít khí hidro (đktc).
- Tính khối lượng miếng nhôm đã phản ứng
- Axit clohidric còn dư hay không? Nếu còn dư thì khối lượng dư là bao nhiêu?
Lưu ý: Các lượng chất được tính theo lượng của sản phẩm
Phương trình phản ứng hóa học: 2Al + 6HCl → 2AlCl3 + 3H2
Theo phương trình: 2 mol 6 mol 3 mol
Theo đầu bài: 0,2 mol 0,05 mol
x mol y mol 0,05 mol
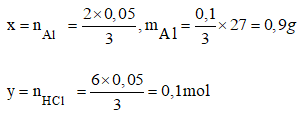
Số mol HCl dư = Số mol HCl ban đầu - Số mol HCl phản ứng = 0,2 - 0,1 = 0,1 mol
=> Khối lượng HCl dư là: 0,1 x 36,5 = 3,65g
Ví dụ 2. Sắt tác dụng với dung dịch CuSO4 theo phương trình:
Fe + CuSO4 → FeSO4 + Cu
Nếu cho 11,2 g sắt vào 40 g CuSO4. Tính khối lượng Cu thu được sau phản ứng.
Hướng dẫn giải
nFe = mFe/MFe = 11,2/56 = 0,2 (mol)
nCuSO4 = mCuSO4/MCuSO4 = 40/160 = 0,25 (mol)
Phương trình hóa học: Fe + CuSO4→ FeSO4 + Cu
Theo phương trình: 1 1 1 1
Theo đầu bài: 0,2 0,25
Phản ứng: 0,2 0,2 0,2 0,2
Sau phản ứng CuSO4 dư, Fe phản ứng hết.
mCu = nCu.MCu = 0,2.64 = 12,8 (gam)
Ví dụ 3. Cho sắt tác dụng với dd axit H2SO4 theo sơ đồ sau:
Fe + H2SO4 → FeSO4 + H2
Có 22,4 g sắt tác dụng với 24,5 g H2SO4. Tính:
a) Thể tích khí H2 thu được ở đktc.
b) Khối lượng các chất còn lại sau phản ứng.
Hướng dẫn giải bài tập
nFe = 22,4/56 = 0,4 (mol)
nH2SO4 = mH2SO4/MH2SO4 = 24,5/9 = 0,25 (mol)
Phương trình phản ứng: Fe + H2SO4→ FeSO4 + H2
Theo phương trình: 1 1 1 1
Theo phản ứng: 0,4 0,25
Theo đầu bài: 0,25 0,25 0,25 0,25
Sau phản ứng: 0,15 0
a) VH2= nH2.22,4 = 0,25.22,4 = 5,6 lít
b) Các chất còn lại sau phản ứng là
mCuSO4 = nCuSO4.MCuSO4 = 0,25.152 = 38 (gam)
mFe dư = nFe. MFe = 0,15.56 = 8,4 (gam)
4. Bài tập vận dụng
Câu 1. Cho 8,1g nhôm vào cốc đựng dung dịch loãng chứa 29,4g H2SO4.
a) Sau phản ứng nhôm hay axit còn dư?
b) Tính thể tích H2 thu được ở đktc?
c) Tính khối lượng các chất còn lại trong cốc?
Hướng dẫn giải bài tập
Phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
nAl = 8,1/27 = 0,3mol
nH2SO4 = 29,4/98 = 0,3mol
Lập tỉ lệ 0,3/2 > 0,3/3
⇒ Al dư.
b,Theo pt: nH2 = nH2SO4 = 0,3mol
⇒ VH2 = 0,3.22,4 = 6,72l
c, nAl(dư) = 0,3−0,3.23 = 0,1mol.
⇒ mAl(dư) = 0,1.27 = 2,7g
Theo pt: nAl2(SO4)3 = 13nH2SO4 = 0,1mol
⇒mAl2(SO4)3 = 0,1.342 = 34,2g.
(Đáp án: a) Al dư, b) 6,72 lít, c) m H2SO4 =34,2g, m Al dư = 2,7g)
Câu 2. Đốt cháy 6,2 g photpho trong bình chứa 6,72 lít khí O2 (đktc)
a) Chất nào còn dư, và dư bao nhiêu?
b) Tính khối lượng sản phẩm thu được?
Đáp án hướng dẫn giải
Số mol theo đề bài
nP = 6,2/31 = 0,2 (mol)
nO2 = 6,72/22,4 =0,3 (mol)
Phương trình phản ứng
4P + 5O2 → 2P2O5
Theo đề bài: 0,2 0,3
Phản ứng : 0,2 0,25 0,1
Sau phản ứng: 0 0,05 0,1
=> Sau phản ứng oxi dư, các chất tính theo chất hết
mO2 dư = 0,05 x 32 =1,6 (g)
b) P2O5 là chất tạo thành
mP2O5 = 0,1 x 142 = 14,2 (g)
(Đáp án: a) O dư, 1,6g, b) m P2O5 = 14,2g)
Câu 3. Đốt 4,6 g Na trong bình chứa 4,48 lít O2 (đktc)
a) Sau phản ứng chất nào dư, dư bao nhiêu gam?
b) Tính khối lượng chất tạo thành?
Đáp án hướng dẫn giải
a, Phương trình hóa học
4Na + O2 →to 2Na2O
Số mol theo đề bài
nNa = 4,6/23 = 0,2 mol.
nO2 = 4,48/22,4 = 0,2 mol.
Lập tỉ lệ: 0,2/4 < 0,2/1⇒ O2 dư.
nO2(dư) = 0,2 − 0,2.1/4 = 0,15 mol.
⇒ mO2(dư) = 0,15.32 = 4,8 g.
b, Theo phương trình ta có: nNa2O = 1/2nNa = 0,1 mol.
⇒ mNa2O = 0,2.62 = 6,2 g.
(Đáp án: a) Oxi dư, 4,8g, b) m Na2O =6,2g)
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Cách giải bài toán dư Hóa học 8. Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









