Natri axetat ra metan?
Chúng tôi xin giới thiệu bài Natri axetat ra metan? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Natri axetat ra metan
Câu hỏi: Natri axetat ra metan?
Trả lời:
Điều chế Metan từ Natri Axetat
Trong phòng thí nghiệm có thể điều chế metan bằng cách:
+ Nhiệt phân natri axetat với vôi tôi xút
I. Đôi nét về natri axetat
1. Natri axetat là gì
Natri axetat là hay natri etanoat là muối natri của axit axetic, có công thức hóa học là CH3COONa. Đây là một loại hóa chất có giá rẻ được sản xuất hàng loạt, sử dụng rộng rãi trong rất nhiều ngành hiện nay.
Nó còn biết đến với rất nhiều tên gọi khác như: axetate natri, natri acetate, sodium acetate, sodium salt...
2. Công thức cấu tạo của natri axetat
Công thức cấu tạo của natri axetat
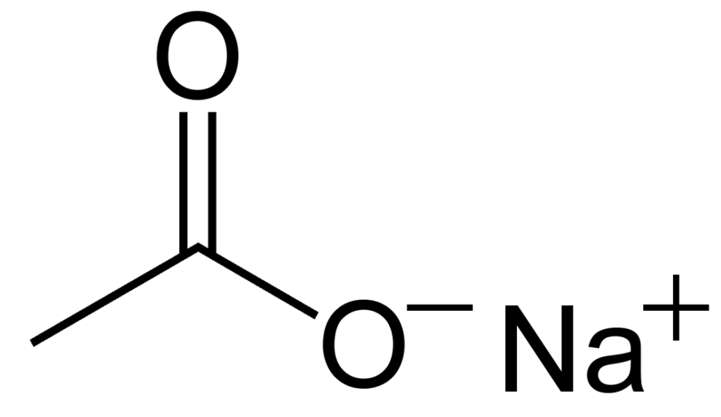
3. Những tính chất hóa lý của natri axetat có thể bạn chưa biết
3.1 Những tính chất vật lý nổi bật của natri axetat
|
Đặc điểm nhận dạng |
Tồn tại dưới dạng bột màu trắng, chảy rữa và không có mùi. |
|
Khối lượng riêng |
1.52 g/cm3 và 1.45 g/cm3 (ở dạng ngậm 3 nước). |
|
Điểm nóng chảy |
324 oC (dạng khan), 58 oC (dạng ngậm 3 nước). |
|
Điểm sôi |
881.4 oC (dạng khan), 122 oC (dạng ngậm 3 nước). |
|
Độ hòa tan trong nước |
36.2 g/100ml (ở 0 oC), 46.4 g/100ml (ở 20 oC), và 170.15 g/100ml (ở 100oC). |
Những tính chất vật lý nổi bật của natri axetat
3.2 Đặc điểm tính chất hóa học của natri axetat
Hóa chất natri axetat có những tính chất hóa học nổi bật như sau:
+ Phản ứng nhiệt phân: Natri axetat khử caboxyl để tạo ra metan trong điều kiện cưỡng bức (nhiệt phân dưới sự có mặt của natri hydroxit):
CH3COONa + NaOH → CH4 + Na2CO3
+ Hoặc ta cũng có th dùng trong điều chế ra este với một alkyl halua như là brometan:
CH3COO-Na+ + Br-CH2-CH3 → CH3COOCH2 – CH3 + NaBr
4. Điều chế natri axetat CH3COONa như thế nào?
+ Để điều chế natri axetat trong phòng thí nghiệm, ta thường áp dụng phản ứng của axit axetic với natri cacbonat, natri hydrocacbonat hoặc natri hydroxit:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
+ Thế nhưng trong thực tế, vì natri axetat có giá thành khá rẻ nên có thể được mua thường xuyên từ người cung cấp hóa chất thay vì phải tổng hợp từ trong phòng thí nghiệm.
5. Những ứng dụng quan trọng của natri axetat trong cuộc sống, sản xuất
5.1 Ứng dụng của natri axetat CH 3 COONa trong ngành thực phẩm
+ Chúng được biết đến như một loại gia vị có thể thêm vào thực phẩm.
+ Sử dụng dưới dạng natri điaxetat – đây là một loại hợp chất tỉ lệ 1:1 của natri axetat cùng axit axetic để thay thế cho muối, dùng nhiều trong khoai tây chiên.
Ứng dụng của natri axetat trong ngành thực phẩm
5.2 Ứng dụng trong các ngành công nghiệp
+ Trong công nghiệp dệt: Hóa chất này giúp trung hòa nước thải có chứa axit sulfuric hay là chất cản màu trong khi sử dụng thuốc nhuộm anilin.
+ Đây cũng là chất tẩy trong nghề thuộc da, có vai trò vô cùng quan trọng giúp làm trì hoãn sự lưu hóa chloropren trong sản xuất cao su nhân tạo.
5.3 Ứng dụng trong dung dịch đệm
Dung dịch natri axetat và axit axetic có thể hoạt động như là một chất đệm giúp giữ cho độ pH ổn định một cách tương đối.
II. Khí metan là gì? Tìm hiểu tính chất và ứng dụng quan trọng của chúng
Metan là một trong những khí quen thuộc trong cuộc sống hiện nay, có trong tự nhiên khá nhiều. Bài viết này sẽ chia sẻ chi tiết đến bạn về những đặc điểm tính chất của chúng, cùng những ứng dụng quan trọng. Hãy cùng theo dõi qua bài viết sau.
1. Khí metan là gì?
Khí metan hay còn có tên gọi khác là khí bùn ao, có kí hiệu là CH4.
Chúng là thành phần chính của khí dầu mỏ, có trong tự nhiên khá nhiều, và được tạo ra trong quá trình chế biến, chưng cất hay sản xuất khí dầu mỏ, xuất hiện nhiều trong các gia đình (như trong các bình gas).
2. Những tính chất vật lí của khí metan CH4
+ Metan là một chất khí không màu, không mùi, không vị.
+ Đây là một khí rất độc và dễ bắt cháy, tạo ra lửa có màu xanh.
+ CH4 hóa lỏng khi ở -162°C, còn hóa rắn ở -183°C.
+ Điểm bốc cháy: 537°C.
+ Khối lượng riêng của metan: 0.717 kg/m3
+ Đây là chất không có khả năng hòa tan trong các dung môi phân cực vì không có sự liên kết giữa các hidro, chúng chỉ tan trong dung môi không phân cực.
+ CH4 không có tính dẫn điện.
3. Những đặc điểm tính chất hóa học của CH4
Metan có thể tham gia vào một số phản ứng hóa học như sau:
3.1 Tham gia phản ứng thế với halogen clo, brom
Metan phản ứng với Halogen cho ra dẫn xuất halogen và hidro halogenua.Ví dụ đối với Cl:
CH4 + Cl2 → CH3Cl + HCl
CH3Cl + Cl2 → CH2Cl2 + HCl
CH2Cl2 + Cl2 → CHCl3 + HCl
CHCl3 + Cl2 → CCl4 + HCl
3.2 Phản ứng với hơi nước tạo ra khí CO
CH4 + H2O = CO + H2O
(Điều kiện phản ứng: Nhiệt độ 1000, Chất xúc tác Ni).
3.3 Phản ứng cháy với oxi
Phản ứng cháy hoàn toàn:
CH4 + 2O2 → CO2 + 2H2O + Q
Q= −891 kJ/mol ở 25oC, 1 atm
Phản ứng cháy không hoàn toàn: Được dùng trong sản xuất fomanđehit, bột than, khí đốt,…
(đốt trong điều kiện thiếu không khí)
3.4 Phản ứng phân hủy tạo ra axetilen
Metan bị nhiệt phân bằng cách nung nóng nhanh metan với một lượng nhỏ oxi ở nhiệt độ khoảng 1500oC (ΔH = 397kJ/mol)
Oxi được dùng để đốt cháy 1 phần metan, cung cấp thêm nhiệt cho phản ứng.
4. Những ứng dụng quan trọng của metan trong cuộc sống
Metan được ứng dụng rất nhiều trong đời sống và sản xuất:
4.1 CH 4 được dùng làm nhiên liệu
CH4 là một nhiên liệu không thể thiếu trong đời sống, đặc biệt chúng có trong khí gas. Khi nấu bằng khí gas hay đồ sưởi ấm giúp bạn giảm bớt lượng thải CO, CO2 ra ngoài không khí thay vì dùng bằng than hay củi.
4.2 Ứng dụng trong ngành công nghiệp
Metan tham gia nhiều trong các phản ứng hóa học ở nhiều dạng khác nhau: rắn, lỏng, khí. Trong các ngành công nghiệp hóa học, metan là nguyên liệu tạo ra một số chất quan trọng như hydro, methanol, axit axetic và anhydrit axetic.
5. Metan có ở đâu trong tự nhiên?
+ Tạo ra từ các khí thải của việc đốt cháy nhiên liệu hóa thạch, hay cháy rừng.
+ CH4 còn có trong quá trình sinh học như ở trong ruột của động vật, tiêu biểu là sự men hóa trong đường ruột, dạ dày của động vật nhai lại.
+ Tạo ra do sự phân hủy kị khí ở những nơi ao hồ, đầm lầy, trầm tích dưới đáy biển… Dưới hầm cầu chúng cũng xuất hiện vì sự lên men yếm khí.
+ CH4 là một trong những thành phần chính của khí tự nhiên, đặc biệt là khí dầu mỏ, do đó mà chúng rất dễ bắt cháy.
+ CH4 còn có nhiều ở trong những hang động, đá giếng sâu. Vì thế, không nên tuyệt đối tự ý đi xuống dưới giếng, hố sâu khi không được chuẩn bị kĩ càng.
Lưu ý:
+ Tuy khí metan không độc trực tiếp nhưng cũng gây khá nhiều nguy hiểm cho con người như: dễ bắt cháy gây nổ, tích tụ quá nhiều sẽ gây ngạt thở, hay gây nhiễm độc khí CO.
+ Chúng còn là một trong những chất tạo nên hiện tượng hiệu ứng nhà kính, nóng lên toàn cầu, gây nguy hiểm đến con người và các loài sinh vật.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Natri axetat ra metan? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









