Nêu các bước tính theo phương trình hóa học?
Nêu các bước tính theo phương trình hóa học? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Các bước tính theo phương trình hóa học
Câu hỏi: Nêu các bước tính theo phương trình hóa học?
Trả lời:
Các bước tính theo phương trình hóa học:
Bước 1. Viết phương trình hóa học.
Bước 2. Chuyển đổi khối lượng chất hoặc thể tích chất khí thành số mol chất
Bước 3. Dựa vào phương trình hóa học để tìm số mol chất tham gia hoặc chất tạo thành.
Bước 4. Chuyển đổi số mol chất thành khối lượng (m = n . M) hoặc thể tích khí ở đktc (V = 22,4. n).
Ví dụ: Đốt cháy hoàn toàn 6,5 gam Zn trong oxi thu được ZnO.
a. Tính khối lượng ZnO thu được?
b. Tính thể tích oxi ở điều kiện tiêu chuẩn đã phản ứng.
Giải:
Phương trình hóa học:
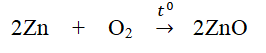
Số mol Zn tham gia phản ứng:
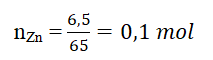
Theo phương trình hóa học ta có:
2 mol Zn tham gia phản ứng cần 1 mol O2, sinh ra 2 mol ZnO
Vậy 0,1 mol Zn tham gia phản ứng cần 0,05 mol O2, sinh ra 0,1 mol ZnO.
Khối lượng ZnO thu được là:
mZnO = nZnO . MznO = 0,1. 81 = 8,1 g.
Thể tích khí O2cần dùng là:
VO2 = nO2 . 22,4 = 0,05.22,4 = 1,12 lít.
1. Tìm khối lượng chất tham gia và chất sản phẩm
Cách làm:
+ Bước 1: Viết phương trình
+ Bước 2: tính số mol các chất
+ Bước 3: dựa vào phương trình tính được số mol chất cần tìm
+ Bước 4: tính khối lượng
Áp dụng nắm chắc các công thức hóa học được cho dưới đây:
m = n . M
M : Khối lượng (g)
n: số mol (mol)
M: Khối lượng mol (g/mol)
n = V /22,4
V: thể tích khí ở đktc
Thí dụ 1: cho 4 gam NaOH tác dụng với CuSO4 tạo ra Cu(OH)2 kết tủa và Na2SO4. Tính khối lượng Na2SO4
Hướng dẫn giải chi tiết:
Các bước tiến hành:
- Viết phương trình hóa học và cân bằng
2NaOH + CuSO4 → Cu(OH)2↓ + Na2SO4
Tính số mol NaOH tham gia phản ứng
Tính số mol Na2SO4 thu được
Theo PTHH: 1 mol NaOH phản ứng thu được 0,5 mol Na2SO4
Vậy: 0,1 mol NaOH…………………0,05 mol Na2SO4
Tìm khối lượng Na2SO4 thu được
mNa2SO4 = n×M = 0,05×142 = 7,1g
2. Tính thể tích khí tham gia và tạo thành
+ Bước 1: Chuyển đổi thể tích chất khí thành số mol chất
+ Bước 2: Viết phương trình hóa học
+ Bước 3: Dựa vào phương trình phản ứng để tính số mol chất tham gia hoặc sản phẩm
+ Bước 4: Áp dụng công thức tính toán theo yêu cầu đề bài
Ví dụ 1: Lưu huỳnh cháy trong oxi hoặc trong không khí sinh ra lưu huỳnh đioxit SO2. Hãy tính thể tích (đktc) sinh ra, nếu có 4g khí O2 tham gia phản ứng
- Viết PTHH
S + O2 → SO2 (DK: to)
- Tìm số mol O2 sinh ra sau phản ứng:
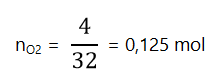
- Tìm số mol SO2 sinh ra sau phản ứng
Theo PTHH: 1 mol O2 tham gia phản ứng sinh ra 1 mol SO2
Vậy: 0,125 mol O2 …………………………. 0,125 mol SO2
- Tìm thể tích khí SO2(đktc) sinh ra sau phản ứng
VSO2 = n.22,4 = 0,125.2,24 = 2,8 lít
Ví dụ 2: Cacbon cháy trong oxi hoặc trong không khí sinh ra khí cacbon đioxit: C + O2 → CO2 (DK: to). Tính thể tích khí CO2 (đktc) sinh ra, nếu có 4 gam khí O2 tham gia phản ứng.
Lời giải
Ta có: nO2=mO2 / MO2= 4 / 32= 0,125 (mol)
PTHH: C + O2 → CO2 (DK: to)
1 mol 1mol 1mol
0,125mol ?mol
Theo PTHH, ta có: số mol CO2 sinh ra là: nCO2 = 0,125.11 = 0,125 mol
=> Thể tích khí CO2 là: VCO2= n . 22,4 =0,125 . 22,4 = 2,8 lít
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Nêu các bước tính theo phương trình hóa học? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









