Cân bằng phương trình sau: C ra CO2?
Cân bằng phương trình sau: C ra CO2? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cân bằng PTHH sau: C ra CO2?
Câu hỏi: Cân bằng PTHH sau: C ra CO2?
Trả lời:
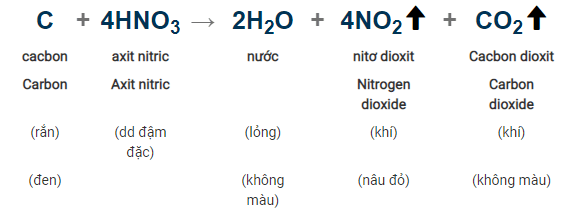
- Điều kiện phản ứng: Nhiệt độ
- Cách thực hiện phản ứng: cho cacbon tác dụng với dung dịch HNO3
- Hiện tượng nhận biết: Chất rắn màu đen (C) tan dần và xuất hiện khí nâu đỏ Nito dioxit (NO2) làm sủi bọt khí.
- Thông tin thêm: Khi đun nóng, HNO3 đặc có thể oxi hoá được các phi kim như C, S, P
1. Cacbon là gì?
Carbon (bắt nguồn từ từ tiếng Pháp carbone /kaʁbɔn/, tên cũ: Cacbon), là nguyên tố hóa học trong bảng tuần hoàn có ký hiệu là C và số nguyên tử bằng 6, nguyên tử khối bằng 12. Là một nguyên tố phi kim có hóa trị 4 phổ biến, carbon có nhiều dạng thù hình khác nhau, phổ biến nhất là 4 dạng thù hình gồm carbon vô định hình, graphit, kim cương và Q-carbon.
Các sợi carbon là tương tự như carbon thủy tinh. Dưới các xử lý đặc biệt (kéo giãn các sợi hữu cơ và carbon hóa) nó có khả năng sắp xếp các mặt tinh thể carbon theo hướng của sợi. Vuông góc với trục của sợi không có các mặt tinh thể carbon. Kết quả là các sợi có độ bền đặc biệt cao hơn cả thép.
Carbon tồn tại đa số trong mọi sự sống hữu cơ và nó là nền tảng của hóa hữu cơ. Phi kim này còn có thuộc tính hóa học đáng chú ý là có khả năng tự liên kết với nó và liên kết với một loạt các nguyên tố khác, tạo ra gần 10 triệu hợp chất đã biết. Khi liên kết với oxy nó tạo ra carbon dioxide là rất thiết yếu đối với sự sinh trưởng của thực vật. Khi liên kết với hydro, nó tạo ra một loạt các hợp chất gọi là các hydrocarbon là rất quan trọng đối với công nghiệp trong dạng của các nhiên liệu hóa thạch. Khi liên kết với cả oxy và hydro nó có thể tạo ra rất nhiều nhóm các hợp chất bao gồm các acid béo, là cần thiết cho sự sống, và este, tạo ra hương vị của nhiều loại hoa quả.
Đồng vị carbon-14 được sử dụng trong xác định tuổi tuyệt đối cho các mẫu vật nguồn gốc sinh vật theo phương pháp định tuổi bằng đồng vị carbon, được ứng dụng trong khảo cổ học và nghiên cứu địa chất kỷ Đệ Tứ.
2. Trạng thái tự nhiên của Cacbon
- Kim cương và than chì là cacbon ở dạng tự do gần như tinh khiết.
- Cacbon còn có trong các khoáng vật như canxit (đá vôi, đá hoa, đá phấn đều chứa CaCO3), magiezit (MgCO3), đolomit (CaCO3.MgCO3). Dầu mỏ, khí thiên nhiên là hỗn hợp của các chất khác nhau chứa cacbon. Cơ thể động thực vật cũng chứa nhiều hợp chất của cacbon.
3. Tính chất vật lý của Cacbon
- C có nhiều dạng thù hình: kim cương, than chì và C vô định hình, fuleren:
- Kim cương là chất tinh thể trong suốt, không màu, không dẫn điện, dẫn nhiệt kém. Kim cương có cấu trúc tinh thể nguyên tử và cứng nhất trong tất cả các chất.
- Than chì là tinh thể màu xám đen, có ánh kim, dẫn điện tốt nhưng kém kim loại. Tinh thể than chì có cấu trúc lớp.
4. Tính chất hóa học của Cacbon
- C có thể tồn tại với nhiều mức oxi hóa khác nhau nhưng thường gặp là: -4; 0; +2; +4.
- C có cả tính khử và tính oxi hoá nhưng tính khử vẫn là chủ yếu.
C là chất khử
- Tác dụng với các phi kim:
C + O2 → CO2
C + CO2 → 2CO (400oC)
- Tác dụng với oxit kim loại:
+ C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học của kim loại:
CuO + C → Cu + CO (to)
Fe2O3 + 3C → 2Fe + 3CO (to)
+ Với CaO và Al2O3:
CaO + 3C → CaC2 + CO (trong lò điện)
2Al2O3 + 9C → Al4C3 + 6CO (2000oC)
- Tác dụng với các chất oxi hóa mạnh thường gặp H2SO4 đặc, HNO3, KNO3, KClO3, K2Cr2O7... trong các phản ứng này, C bị oxi hóa đến mức +4 (CO2).
C + 2H2SO4 đặc → CO2 + 2SO2 + 2H2O (to)
C + 4HNO3 đặc → CO2 + 4NO2 + 2H2O (to)
C + 4KNO3 → 2K2O + CO2 + 4NO2 (to)
- Khi nhiệt độ cao, C tác dụng được với hơi nước:
C + H2O → CO + H2 (1000oC)
C + 2H2O → CO2 + 2H2
C là chất oxi hóa
- Tác dụng với H2:
C + 2H2 → CH4 (500oC; Ni)
- Tác dụng với kim loại → muối cacbua:
4Al + 3C → Al4C3 (to)
5. Ứng dụng của Cacbon
- Kim cương được dùng làm đồ trang sức. Trong kĩ thuật, kim cương được dùng làm mũi khoan, dao cắt thuỷ tinh, bột mài.
- Than chì được dùng làm điện cực; làm nồi, chén để nấu chảy các hợp kim chịu nhiệt; chế tạo chất bôi trơn; làm bút chì đen.
- Than cốc được dùng làm chất khử trong luyện kim để luyện kim loại từ quặng.
- Than gỗ được dùng để chế thuốc nổ đen, thuốc pháo, chất hấp phụ.
- Than muội được dùng làm chất độn khi lưu hoá cao su, để sản xuất mực in, xi đánh giày.
6. Điều chế của Cacbon
- Cách để điều chế carbon là dùng kim loại mạnh là nhôm hoặc magnesi để khử một hợp chất oxide carbon bất kì thành carbon.
Ví dụ:
2Al + 3CO → Al2O3 + 3C
2Mg + CO2 → 2MgO + C
- Sau đó cho hỗn hợp vào một dung dịch acid (không có tính oxy hóa mạnh) như HCl, H2SO4 loãng để hòa tan Al2O3 hoặc MgO, còn lại carbon không tan, ta lọc carbon ra khỏi dung dịch.
- Ngoài ra có thể điều chế carbon theo các phương trình sau nhưng hiệu suất không cao do khí hydro rất dễ bay lên:
CO + H2 ↔ C + H2O (Nhiệt độ khoảng 1050 độ C)
CO + 3H2 → CH4↑ + H2O (Chất xúc tác: Nickel, 250 độ C)
CO2 + 4H2 → CH4↑ + 2H2O (Xúc tác, nhiệt độ cao, áp suất cao)
CH4 → C + 2H2↑ (Nhiệt độ trên 1000 độ C)
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Cân bằng phương trình sau: C ra CO2? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8








