HSO4 hóa trị mấy?
HSO4 hóa trị mấy? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
HSO4 hóa trị mấy?
HSO4 hóa trị mấy?
Ion HSO4- (gọi là hydrogen sulfate hay bisulfate) có:
Nguyên tử S (lưu huỳnh) trong gốc SO₄²⁻ có số oxi hóa +6.
Khi thêm một nguyên tử H+ gắn vào, ta được ion HSO4-.
👉 Vậy:
HSO4- có hóa trị I (một âm), tức là mang điện tích –1.
Nếu xét riêng gốc slnfate (SO4) thì gốc đó có hóa trị II.
Hóa trị của một số nhóm nguyên tử
|
Công thức acid tương ứng |
Gốc Acid |
Tên gốc |
Hóa trị |
|
HCl |
- Cl |
-chloride |
I |
|
HBr |
- Br |
-bromide |
I |
|
H2S |
= S |
-sulfide |
II |
|
- HS |
-hydrogen sulfide |
I |
|
|
HNO2 |
- NO2 |
-nitrite |
I |
|
HNO3 |
- NO3 |
-nitrate |
I |
|
H2SO3 |
= SO3 |
-sulfite |
II |
|
- HSO3 |
-hydrogen sulfite |
I |
|
|
H2SO4 |
= SO4 |
-sulfate |
II |
|
- HSO4 |
- hydrogen sulfate |
I |
|
|
H3PO4 |
- H2PO4 |
-dihydrogen phosphate |
I |
|
= HPO4 |
-hydrogen phosphate |
II |
|
|
≡ PO4 |
-phosphate |
III |
|
|
H2CO3 |
= CO3 |
-carbonate |
II |
|
- HCO3 |
-hydrogen carbonate -bicarbonate |
I |
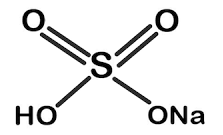
I. NaHSO4 muối của HSO4-
- Là muối của Na với gốc hydrogen sulfate HSO4.
- Công thức cấu tạo:
II. Tính chất hóa học của Sodium hydrogen sulfate
– Phương trình phân li:
NaHSO4 → Na+ + HSO4–
– Tác dụng với kim loại:
NaHSO4 + Zn → ZnSO4 + Na2SO4 + H2
NaHSO4 + Na → Na2SO4 + H2
– Tác dụng dung dịch Base:
NaHSO4 + NaOH → Na2SO4 + H2O
NaHSO4 + Ba(OH)2 → BaSO4 + Na2SO4 + H2O
- Tác dụng với dung dịch base (NaOH; KOH; Ca(OH)2; Ba(OH)2) → phản ứng trung hòa
NaHSO4 + NaOH → Na2SO4 + H2O
NaHSO4 + Ba(OH)2 → BaSO4 + Na2SO4 + H2O
- Phản ứng của 2 muối axit với nhau: (muối acid mạnh sẽ đóng vai trò là axit; muối axit yếu sẽ đóng vai trò là base)
NaHSO4 + NaHCO3 → Na2SO4 + CO2 + H2O
- Phản ứng nhiệt phân:
2NaHSO4 ![]() \(\overset{t^{o} }{\rightarrow}\)Na2S2O7 + H2O
\(\overset{t^{o} }{\rightarrow}\)Na2S2O7 + H2O
Sodium persulfate
Na2S2O7 ![]() \(\overset{t^{o} }{\rightarrow}\) Na2SO4 + SO3
\(\overset{t^{o} }{\rightarrow}\) Na2SO4 + SO3
III. Các phản ứng điều chế NaHSO4
NaClO + NaHSO3 → NaHSO4 + NaCl
H2O + O2 + Na2S2O4 → NaHSO4 + NaHSO3
H2SO4 (Đậm đặc) + Na2SO4 → 2NaHSO4
H2O + NaHSO3 + 2CuSO4 + 2NaCN → 3NaHSO4 + 2CuCN
NaH SO4.H2O → NaHSO4 + H2O
H2SO4 + NaBr → NaHSO4 + HBr
H2SO4 + NaHSO3 → NaHSO4 + H2O + SO2
Cl2 + H2O + NaHSO3 → NaHSO4 + 2HCl
HNO3 + Na(SO3NH2) → NaHSO4 + NO2NH2
H2SO4 + NaN3 → NaHSO4 + HN3
3H2SO4 + Na2S → 2NaHSO4 + 2H2O + S + SO2
H2SO4 + NaF → NaHSO4 + HF
H2SO4 + NaNO3 → NaHSO4 + HNO3
NaOH + SO3 → NaHSO4
H2SO4 + NaCl → NaHSO4 + HCl
4H2SO4 + 2NaCl + PbO2 → 2NaHSO4+ Cl2 + 2H2O + Pb(HSO4)
IV. Một số ứng dụng
- Trong kĩ thuật, nó được dùng trong chế tác kim loại (giai đoạn cuối).
- Mặt khác nó dùng để làm sạch sản phẩm, và làm giảm độ pH của nước để việc khử trùng bằng clo có hiệu quả, bao gồm cả hồ bơi.
- Sodium Hydrogen Sulfate (NaHSO4) còn được AAFCO phê duyệt làm chất phụ gia trong thức ăn, kể cả thức ăn cho động vật.
- Trong thú y, Sodium Hydrogen Sulfatecòn làm chất oxi hoá nước tiểu để giảm thiểu sỏi tiết niệu cho mèo.
- Trong ngành kim hoàn, Natri Bisulfat là nguyên liệu chính dùng trong dung dịch axit làm tẩy để loại bỏ lớp kim loại bị oxi hoá ở bề mặt sau khi nung nóng.
V. Bài tập ví dụ
Ví dụ 1: Nhỏ NaHSO4 vào ống nghiệm chứa NaHSO3 thu được hiện tượng là
- Có khí không màu thoát ra.
- Có khí màu nâu đỏ thoát ra.
- Có khí màu vàng lục thoát ra.
- Không có hiện tượng gì.
Hướng dẫn giải
NaHSO3 + NaHSO4 → Na2SO4 + SO2 ↑ + H2O
SO2: khí không màu.
Đáp án A.
Ví dụ 2:
Thể tích khí ở dkc thoát ra khi cho 10,4g NaHSO3 phản ứng hoàn toàn với lượng dư NaHSO4 là (bỏ qua sự hòa tan của SO4 vào nước)
- 1,12 lít.
- 2,24 lít.
- 3,36 lít.
- 4,48 lít.
Hướng dẫn giải
NaHSO3 + NaHSO4 → Na2SO4 + SO2 + H2O
0,1mol 0,1 mol
V = 0,1.24,79 = 2,479 lít.
Đáp án B.
Ví dụ 3: Số muối axit trong các muối sau: KHCO3; NaHSO4; K2HPO3; KHSO3; (NH4)2CO3; K2HPO4.
- 3
- 4
- 5
- 6
Đáp án B
Ví dụ 4:
Khi cho dung dịch NaHSO4 vào dung dịch nào sẽ xuất hiện kết tủa:
- Ba(NO3)2
- Mg(NO3)2
- Cu(NO3)2
- Zn(NO3)2
* Hướng dẫn giải
Đáp án A
NaHSO4 + Ba(NO3)2 → BaSO4↓ + NaNO3 + HNO3









