Nêu cách xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hóa học của hợp chất?
Chúng tôi xin giới thiệu bài Nêu cách xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hóa học của hợp chất? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Xác định thành phần phần trăm theo khối lượng của các nguyên tố
Câu hỏi: Nêu cách xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hóa học của hợp chất?
Trả lời:
Các bước tiến hành
+ Bước 1. Tìm khối lượng mol (M) của hợp chất.
+ Bước 2. Tìm số mol nguyên tử của mỗi nguyên tố trong 1 mol hợp chất.
+ Bước 3. Tìm thành phần theo khối lượng của mỗi nguyên tố trong hợp chất.
Ví dụ: Tính thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất Fe2O3.
Giải:
- Khối lượng mol phân tử Fe2O3: MFe2O3 = 56.2 + 16.3= 160 gam/mol.
- Trong 1 mol Fe2O3 có: 2 mol nguyên tử Fe, 3 mol nguyên tử O
- Thành phần phần trăm theo khối lượng của mỗi nguyên tố trong hợp chất Fe2O3:
+ %mFe = (2.56/160) . 100% = 70%
+ %mO = (3.16/160) . 100% = 30%
Hoặc %mO = 100% - 70% = 30%.
Bài 1: Xác định thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất KNO3
Hướng dẫn giải:
+ Khối lượng mol của hợp chất: MKNO3 = 39 + 14 + 16.3 = 101 gam/mol
+ Trong 1 mol KNO3 có: 1 mol nguyên tử K; 1 mol nguyên tử N và 3 mol nguyên tử O
+ Thành phần phần trăm theo khối lượng của các nguyên tố là:
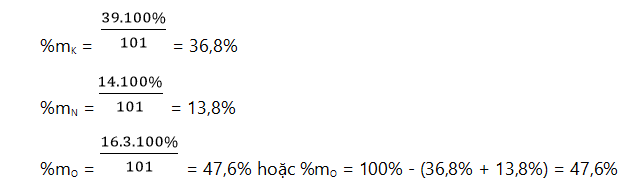
Bài 2: Oxi hóa hoàn toàn 0,135 gam hợp chất hữu cơ A rồi cho sản phẩm lần lượt qua bình 1 chứa H2SO4 đặc và bình 2 chứa KOH, thì thấy khối lượng bình 1 tăng lên 0,117 gam, bình 2 tăng thêm 0,396 gam. Ở thí nghiệm khác, khi nung 1,35 g hợp chất A với CuO thì thu được 112 ml (đktc) khí nitơ. Tính thành phần phần trăm của các nguyên tố trong phân tử chất A.
Hướng dẫn giải
Khối lượng bình 1 tăng là khối lượng của H2O
⇒nH = 2nH2O=2.0,11718=0,013mol
Khối lượng bình 2 tăng là khối lượng của CO2
⇒nC = nCO2 = 0,39644 =0,009 mol
Số mol N trong 0,135 gam hợp chất hữu cơ A là :
nN = nN2 =2.0,11222,4.10 = 0,001mol
Vậy:
%mC = 12.0,0090,135.100% = 80%
%mH = 1.0,00130,135.100% = 9,63%
%mN = 14.0,0010,135.100% = 10,37%
%mO = 100% – (80% + 9,63% + 10,37%) = 0%
Bài 3: Một hợp chất có công thức hóa học C6H12O6. Hãy cho biết:
a) Khối lượng mol của hợp chất đã cho.
b) Thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất.
Hướng dẫn giải
a) Khối lượng mol của hợp chất:
MC6H12O6 = 12.6 + 1.12 + 16.6 = 180 g/mol
b) Thành phần phần trăm theo khối lượng của các nguyên tố có trong hợp chất:
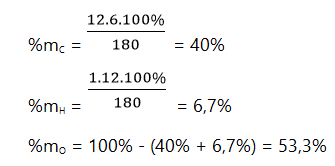
Bài 4: Oxi hóa hoàn toàn 0,6 gam hợp chất hữu cơ A thu được 0,672 lit khí CO2 (đktc) và 0,72 gam H2O. Tính thành phần phần trăm khối lượng của các nguyên tố trong phân tử chất A?
Hướng dẫn giải
Oxi hóa A thu được CO2 và H2O
⇒ hợp chất A có C, H có thể có O.
nCO2 = 0,672 / 22,4 = 0,03 mol
nH2O = 0,7218 = 0,04mol
⇒ nC = nCO2= 0,03 mol
nH = 2nH2O= 0,08 mol
Vậy:
%mC = 12.0,030,6.100% = 60%;
%mH = 1.0,080,6.100% = 13,33%
%mO = 100% – (60% + 13,33%) = 26,67%
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Nêu cách xác định thành phần phần trăm theo khối lượng của các nguyên tố trong hợp chất khi biết công thức hóa học của hợp chất? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









