Cân bằng phương trình hóa học sau: Al2O3 ra Al
Chúng tôi xin giới thiệu bài Cân bằng phương trình hóa học sau: Al2O3 ra Al được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cân bằng PTHH sau: Al2O3 ra Al?
Câu hỏi: Cân bằng PTHH sau: Al2O3 ra Al?
Trả lời:
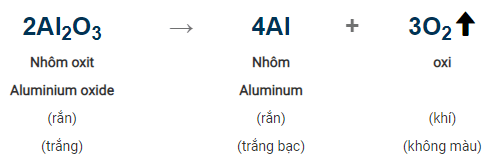
- Điều kiện phản ứng: Nhiệt độ: 900°C, điều kiện khác: đpnc
- Cách thực hiện phản ứng: điện phân nóng chảy Al2O3.
- Hiện tượng nhận biết: Có khí thoát ra
1. Al (nhôm) là gì?
Nhôm (bắt nguồn từ tiếng Pháp: aluminium, phiên âm tiếng Việt là: a-luy-mi-nhôm) là 1 nguyên tố hóa học có trong bảng tuần hoàn nguyên tố có ký hiệu Al, có số nguyên tử bằng 13.
Nhôm là kim loại có màu trắng bạc, khá mềm, rất nhẹ và có thể dẫn được điện, nhiệt tốt. Nhôm không độc và có chúng khả năng chống mài mòn rất tốt. So với các kim loại khác thì nhôm được sử dụng nhiều trong đời sống và trong các ngành công nghiệp phổ biến, đặc biệt là trong công nghiệp sản xuất ô tô. Kim loại Nhôm có độ phản chiếu cao cũng như có đặc tính dẫn nhiệt và dẫn điện lớn. Nhôm là kim loại không độc hại và có tính chống mài mòn. Nhôm cũng là kim loại có rất nhiều thành phần trong đó.
Trong tự nhiên rất khó để tìm được nguồn khoáng sản nhôm nguyên chất, thông thường kim loại này được tìm thấy khi đã được kết hợp cùng oxygen cùng với những nguyên tố khác. Người ta vẫn thường gọi chúng là hợp kim nhôm.
2. Trạng thái tự nhiên của Al
Nhôm là kim loại phổ biến nhất trong vỏ quả đất. Trong tự nhiên, Al có trong:
- Đất sét: Al2O3.2SiO2.2H2O.
- Mica: K2O.Al2O3.6SiO2.2H2O.
- Boxit: Al2O3.nH2O.
- Criolit: 3NaF.AlF3 hay (Na3AlF6).
3. Đặc điểm tính chất cơ bản của Al
Một trong những tính chất nổi bật nhất của nhôm chính là kim loại nhẹ. So với sắt thép, nhôm chỉ nặng ⅓ trọng lượng. Điều này sẽ giải thích vì sao nhôm luôn được dùng nhiều trong các ngành chế tạo các thiết bị cần quan tâm đến trọng lượng như cửa, máy bay, linh kiện trên không, máy móc.
Nhôm có thể dẫn được điện. Mặc dù tính dẫn điện kém hơn đồng nhưng nhôm được sử dụng phổ biến khi dùng để truyền cùng dòng điện.
Nhôm có tính dẻo. Tính dẻo tạo sự thuận tiện trong sản xuất ra các sản phẩm có dạng tấm, lá, băng hoặc là ép chảy thành các thanh như khung cửa. Khung cửa nhôm các loại hiện nay trên thị trường rất phổ biến.
Một trong những nhược điểm chính không tốt của nhôm đó chính là độ cứng và độ bền khá thấp. Giá trị sử dụng không cao và dễ hư hỏng sau một thời gian dài.
Trong bảng tuần hoàn hóa học, kim loại nhôm ở vị trí số 13, chu kỳ 3 và thuộc nhóm IIIA. Đây là 1 chất thường thấy trong tự nhiên.
4. Tính chất vật lý của Al
- Mạng lập phương tâm diện, dẫn điện, dẫn nhiệt tốt; tonc = 660oC .
- Màu trắng bạc, khá bền và dai, dễ kéo sợi và dát mỏng, nhẹ (D = 2,7).
- Một số hợp kim của nhôm:
+ Đuyra (95% Al; 4% Cu; 1% Mg, Mn, Si): nhẹ bằng 1/3 thép, cứng gần bằng thép.
+ Silumin (gần 90% Al; 10% Si): nhẹ, bền.
+ Almelec (98,5% Al; còn lại là Mg, Si và Fe) dùng làm dây cáp.
+ Hợp kim electron (10,5% Al; 83,3% Mg còn lại là Zn, Mn...): chỉ nặng bằng 65% Al lại bền hơn thép, chịu được sự thay đổi đột ngột của nhiệt độ trong một giới hạn lớn nên được dùng làm vỏ tên lửa.
5. Tính chất hóa học của Al
Nhôm là kim loại có tính khử mạnh, chỉ sau kim loại kiềm và kiềm thổ, nên dễ bị oxi hóa thành ion dương.
Al → Al3+ + 3e
Tác dụng với phi kim
Nhôm khử dễ dàng các nguyên tử phi kim thành ion âm.
- Tác dụng với halogen:
Bột nhôm tự bốc cháy khi tiếp xúc với khí clo.
- Tác dụng với oxi
Khi đốt, bột nhôm cháy trong không khí với ngọn lửa sáng chói, tỏa nhiều nhiệt.
Nhôm bền trong không khí ở nhiệt độ thường do có màng oxit Al2O3 rất mỏng và bền bảo vệ.
Tác dụng với axit
- Nhôm khử dễ dàng ion H+ trong dung dịch HCl và H2SO4 loãng thành khí H2.
- Nhôm tác dụng mạnh với dung dịch HNO3 loãng, HNO3 đặc, nóng và H2SO4 đặc, nóng. Trong các phản ứng này, Al khử N+5 hoặc S+6 xuống số oxi hóa thấp hơn.
- Nhôm bị thụ động bởi dung dịch axit HNO3 đặc, nguội hoặc H2SO4 đặc, nguội nên có thể dùng thùng nhôm để chuyên chở những axit đặc, nguội này.
Tác dụng với oxit kim loại
Ở nhiệt độ cao, Al khử được nhiều ion kim loại trong oxit.
Thí dụ phản ứng giữa bột nhôm và sắt oxit gọi là phản ứng nhiệt nhôm. Nhiệt lượng do phản ứng tỏa ra lớn làm sắt nóng chảy nên phản ứng này được dùng để điều chế một lượng nhỏ sắt nóng chảy khi hàn đường ray.
Tác dụng với nước
Nếu phá bỏ lớp oxit trên bề mặt nhôm (hoặc tạo thành hỗn hống Al - Hg), thì nhôm sẽ tác dụng với nước ở nhiệt độ thường.
Nhôm không tác dụng với nước, dù ở nhiệt độ cao là vì trên bề mặt của nhôm được phủ kín một lớp Al2O3 rất mỏng, bền và mịn, không cho nước và khí thấm qua.
Tác dụng với dung dịch kiềm
Al2O3 là oxit lưỡng tính nên lớp màng mỏng Al2O3 trên bề mặt nhôm tác dụng với dung dịch kiềm tạo ra muối tan. Khi không còn màng oxit bảo vệ, nhôm sẽ tác dụng với nước tạo ra Al(OH)3 và giải phóng khí H2; Al(OH)3 là hiđroxit lưỡng tính nên tác dụng tiếp với dung dịch kiềm.
Như vậy, nhôm có thể tan trong dung dịch kiềm và giải phóng khí hiđro.
6. Ứng dụng và điều chế Al
Ứng d ụ ng
- Trong ngành xây dựng
Bởi tính bền, nhẹ và không dễ bị oxi hóa của nhôm. Mà nhôm được ứng dụng khá rộng rãi trong ngành xây dựng. Những đồ dùng hay các thiết kế được làm từ các hợp chất của nhôm luôn mang lại độ hiệu quả bền bỉ cao. Một vài đồ dùng trong ngành xây dựng được làm bằng nhôm có thể kể đến như:
+ Tôn
+ Cửa đi chính
+ Cửa sổ
+ Mái hiên
+ Khung sườn nhôm
+ Vách ngăn
+ Khung cửa,…
- Trong các ngành công nghiệp
Nhôm là một kim loại nhẹ và có khối lượng riêng rất nhỏ. Ngoài ra nhôm còn có khả năng chống ăn mòn hiện tượng thụ động. Các thành phần cấu trúc mà được làm từ nhôm và hợp chất của nó rất quan trọng và mang lại lợi ích khá lớn cho các ngành công nghiệp hiện nay.
Một số chế tạo từ nhôm và hợp chất của nhôm trong ngành công nghiệp có thể kể đến như:
+ Khung máy
+ Vỏ máy tính được làm từ hợp kim nhôm
+ Một số phần từ các loại xe máy, xe oto được làm từ nhôm
+ Dây cáp điện bằng nhôm
+ Thùng xe tải
+ Là vật liệu để chế tạo tàu bay, tên lửa
+ Bộ tản nhiệt của CPU trong máy tính
+ Vỏ điện thoại, các chi tiết nhỏ bên trong,…
- Trong hàng tiêu dùng
Nhờ độ bền cao của nhôm và không dễ bị oxy hóa. Ứng dụng của nhôm và hợp chất của nhôm trong đồ tiêu dùng là rõ ràng nhất và nhiều nhất. Một vài đồ tiêu dùng được làm từ nhôm như:
+ Bàn, ghế
+ Tủ quần áo
+ Khung tủ đựng chén
+ Kệ chén
+ Giường
+ Thanh treo màn
+ Dụng cụ nấu ăn,…
Điều chế
Hiện nay, cách điều chế chủ yếu nhất là tách kim loại nhôm trong quặng boxit nhôm có lẫn SiO2 và chất Fe2O3.
Bước 1: Làm sạch nguyên liệu bằng cách cho phản ứng với dung dịch kiềm để tách riêng Al2O3.
Bước 2: Sau đó dùng bình điện phân, điện phân nóng chảy nhôm Al2O3 có mặt criolit Na3AlF6. Để thực hiện việc này, chúng ta cần hạ nhiệt độ nóng chảy từ 2050oC xuống 900oC để tạo thành nhiều ion ngăn không cho oxi phản ứng lại với kim loại nhôm để tạo ra lớp oxit bảo vệ.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Cân bằng phương trình hóa học sau: Al2O3 ra Al. Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8








