Cách vẽ sơ đồ cấu tạo nguyên tử
VnDoc xin giới thiệu bài Cách vẽ sơ đồ cấu tạo nguyên tử được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cách vẽ sơ đồ cấu tạo nguyên tử
Câu hỏi: Cách vẽ sơ đồ cấu tạo nguyên tử?
Trả lời:
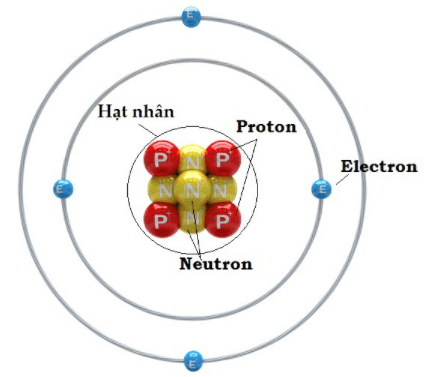
1. Nguyên tử là gì?
Nguyên tử là hạt vô cùng nhỏ trung hoà về điện, đại diện cho nguyên tố hóa học và không bị chia nhỏ hơn trong phản ứng hoá học.
- Nguyên tử gồm 1 hạt nhân mang điện tích dương và vỏ tạo bởi 1 hay nhiều electron mang điện tích âm.
- Hạt electron kí hiệu: e. Điện tích: -1. Khối lượng vô cùng nhỏ: 9,1095 .10-28gam.
Cấu tạo của hạt nhân: gồm hạt cơ bản prôton và nơtron.
* Hạt proton: kí hiệu: p. mang điện tích dương: +1. Khối lượng: 1,6726.10-24g.
* Hạt nơtron: kí hiệu: n. Không mang điện có khối lượng:1,6748.10-24g.
* Các nguyên tử có cùng số prôton trong hạt nhân gọi là các nguyên tử cùng loại.
* Vì nguyên tử luôn trung hòa về điện nên: số prôton = số electron.
* Vì khối lượng của e nhỏ hơn rất nhiều so với khối lượng của n và p vì vậy khối lượng của hạt nhân được coi là khối lượng nguyên tử. mnguyên tử ≈ mhạt nhân.
2. Proton
Proton là hạt điện mang điện dương được tìm thấy bên trong hạt nhân nguyên tử. Nó được khám phá bởi Ernest Rutherford trong các thí nghiệm tiến hành vào những năm 1911 – 1919. Số lượng proton trong một nguyên tử sxe giúp xác định nguyên tố này là nguyên tố gì.
Ví dụ: nguyên tử Cacbon có 6 proton, nguyên tử oxygen có 8 proton và nguyên tử hydrogen có 1 proton. Số lượng proton trong 1 nguyên tử được gọi là số nguyên tử của nguyên tố đó. Bên cạnh đó, số proton trong một nguyên tử còn giúp xác định hành trạng hóa học của mỗi nguyên tố.
Proton được cấu tạo nên từ những hạt khác có tên gọi là quark. Thường sẽ có ba quark trong mỗi proton – hai quark “lên” (up) và một quark “xuống” (down) và chúng được liên kết lại với nhau bởi những hạt khác nữa gọi là gluon.
3. Neutron
- Neutron là một hạt hạ nguyên tử. Neutron là thành phần của 1 quark lên và 2 quark xuống và thuộc họ fermion. Nó được ký hiệu là n hoặc nº. Khối lượng neutron là cao hơn một chút khối lượng proton. Điện tích của nơtron là rỗng, có nghĩa là nơtron là trung hòa về điện. Nơtron nằm bên trong hạt nhân.
- Khối lượng của neutron không thể được tính trực tiếp bằng phương pháp quang phổ khối lượng. Nhưng nó có thể được tính bằng phương pháp gián tiếp.
|
Khối lượng nơtron m N |
1,674927471 (21) * 10 -27 kg |
4. Electron
Electron là một hạt mang điện tích âm có trong nguyên tử. Điện tích trên mỗi electron là - 1,6 × 10 - 19 Coulomb. Các electron này bao quanh hạt nhân. Một số đặc điểm thật về các electron trong nguyên tử được liệt kê và giải thích dưới đây,
- Nếu một nguyên tử có cùng số proton và electron thì nguyên tử đó trung hòa về điện vì điện tích âm của electron trung hòa điện tích dương của proton.
- Các electron quay xung quanh hạt nhân trong các lớp vỏ (còn gọi là quỹ đạo).
- Một lực hút do hạt nhân mang điện tích dương tác dụng lên các êlectron mang điện tích âm. Lực hút này hoạt động như lực hướng tâm cần thiết cho sự quay quanh hạt nhân của các electron.
- Các điện tử ở gần hạt nhân liên kết chặt chẽ với hạt nhân và khó kéo (loại bỏ) các điện tử này ra khỏi nguyên tử hơn các điện tử ở xa hạt nhân.
5. Hạt nhân nguyên tử là gì?
Hạt nhân nguyên tử là bộ phận nằm ở trung tâm của nguyên tử được tạo nên bởi proton và nơtron.
Proton có kí hiệu là p, mang điện tích như electron nhưng khác dấu, ghi bằng dấu dương (+), khối lượng là 1 đvC (đơn vị Cacbon).
Nơtron thì có kí hiệu là n, trung hòa về điện (không mang điện tích) và có khối lượng là 1 đvC.
Những nguyên tử cùng loại sẽ có cùng số proton trong hạt nhân và trong một nguyên tử đó thì số proton sẽ bằng số electron.
Đồng thời proton và nơtron có cùng khối lượng, còn khối lượng của electron rất bé và không đáng kể. Vậy nên khối lượng của hạt nhân được coi là khối lượng của nguyên tử.
Ví dụ: Hydro là nguyên tử nhẹ nhất và cũng là loại nguyên tử duy nhất có 1 hạt proton và không có nơtron. Chính vì tính chất này mà người ta đã sử dụng khí hydro để bơm vào bóng bay giúp bóng bay lên được.
Theo định nghĩa, thì hai nguyên bất kỳ có cùng số proton trong hạt nhân thì sẽ thuộc về cùng một nguyên tố hóa học. Còn các nguyên tử có cùng số proton nhưng lại khác số neutron thì sẽ những đồng vị khác nhau của cùng một nguyên tố. Ví dụ cụ thể cũng chính là nguyên tử hiđrô.
6. Các công thức tính nguyên tử
- 1u = 1,6605. 10-27 kg
- 1Å = 10-8cm = 10-10 m
- Khối lượng nguyên tử tương đối và khối lượng nguyên tử tuyệt đối :
+ Khối lượng tuyệt đối (m) của nguyên tử là khối lượng thực của nguyên tử (rất nhỏ)
+ Khối lượng tương đối của nguyên tử (M) là khối lượng nguyên tử tính theo đơn vị Cacbon (đvC) hay còn gọi là khối lượng mol.
Quy ước 1đvC = 1u = 1/12 khối lượng tuyệt đối của 12C = 1,66 . 10-24 g
+ Mối quan hệ giữa khối lượng tương đối và khối lượng tuyệt đối :
m = 1,66.10-24M (gam) hoặc m = M/(6,023.1023) (gam)
- Nguyên tử có dạng hình cầu có thể tích V = 4/3πr3 (r là bán kính nguyên tử).
- Khối lượng riêng của nguyên tử d = m/V .
- 1 mol nguyên tử chứa N = 6,02.1023 nguyên tử
-------------------------------------------










