Hóa trị là gì? Cách xác định hóa trị của một nguyên tố?
Hóa trị là gì? Cách xác định hóa trị của một nguyên tố? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 8. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hóa trị là gì? Cách xác định hóa trị của một nguyên tố?
Câu hỏi: Hóa trị là gì? Cách xác định hóa trị của một nguyên tố?
Trả lời:
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Cách xác định hóa trị của một nguyên tố:
Quy ước: H hóa trị I; O hóa trị II. Tổng hóa trị của một chất bằng 0.
I. Khái niệm Hóa trị
Hóa trị là con số biểu thị khả năng liên kết của nguyên tử nguyên tố này với nguyên tử nguyên tố khác.
Quy ước: H hóa trị I; O hóa trị II.
(Lấy hóa trị của H làm đơn vị, hóa trị của oxi được xác định bằng hai đơn vị).
Bảng kí hiệu hóa học lớp 8 trang 42
|
Số proton |
Tên Nguyên tố |
Ký hiệu hóa học |
Nguyên tử khối |
Hóa trị |
|
1 |
Hiđro |
H |
1 |
I |
|
2 |
Heli |
He |
4 |
|
|
3 |
Liti |
Li |
7 |
I |
|
4 |
Beri |
Be |
9 |
II |
|
5 |
Bo |
B |
11 |
III |
|
6 |
Cacbon |
C |
12 |
IV, II |
|
7 |
Nitơ |
N |
14 |
II, III, IV… |
|
8 |
Oxi |
O |
16 |
II |
|
9 |
Flo |
F |
19 |
I |
|
10 |
Neon |
Ne |
20 |
|
|
11 |
Natri |
Na |
23 |
I |
|
12 |
Magie |
Mg |
24 |
II |
|
13 |
Nhôm |
Al |
27 |
III |
|
14 |
Silic |
Si |
28 |
IV |
|
15 |
Photpho |
P |
31 |
III, V |
|
16 |
Lưu huỳnh |
S |
32 |
II, IV, VI |
|
17 |
Clo |
Cl |
35,5 |
I,… |
|
18 |
Argon |
Ar |
39,9 |
|
|
19 |
Kali |
K |
39 |
I |
|
20 |
Canxi |
Ca |
40 |
II |
|
24 |
Crom |
Cr |
52 |
II, III |
|
25 |
Mangan |
Mn |
55 |
II, IV, VII… |
|
26 |
Sắt |
Fe |
56 |
II, III |
|
29 |
Đồng |
Cu |
64 |
I, II |
|
30 |
Kẽm |
Zn |
65 |
II |
|
35 |
Brom |
Br |
80 |
I… |
|
47 |
Bạc |
Ag |
108 |
I |
|
56 |
Bari |
Ba |
137 |
II |
|
80 |
Thủy ngân |
Hg |
201 |
I, II |
|
82 |
Chì |
Pb |
207 |
II, IV |
Chú thích:
+ Nguyên tố phi kim: chữ màu xanh
+ Nguyên tố kim loại: chữ màu đen
+ Nguyên tố khí hiếm: chữ màu đỏ
II. Quy tắc hóa trị

A có hóa trị a; B có hóa trị b
x, y là chỉ số của A, B trong phân tử
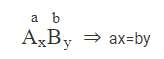
Ví dụ:

III. Cách xác định hóa trị của một nguyên tố.
* Cách xác định hóa trị của một nguyên tố
+ Quy ước: H hóa trị I, chọn làm đơn vị và O có hóa trị II
+ Một nguyên tử nguyên tố khác liên kết với bao nhiêu nguyên tử H thì nói nguyên tố đó có hóa trị là bấy nhiêu.
Ví dụ:
HCl: Cl hóa trị I.
CH4: C …………IV
NH3:N ………..III
H2O:O…………II
+ Tính số liên kết của các nguyên tố khác với số nguyên tử O. (O có hóa trị II; Hóa trị của oxi bằng 2 đơn vị)
Ví dụ:
K2O: K có hóa trị I.
BaO: Ba …………..II.
SO2: S ………………IV.
– Hóa trị của nhóm nguyên tử (NH3, CO3….)
Ví dụ:
HNO3: NO3 có hoá trị I.
Vì: Liên kết với 1 nguyên tử H.
HOH : OH ……………..I
H2SO4: SO4 có hóa trị II.
H3PO4: PO4…………….III.
*Kết luận: Hóa trị là số biểu thị khả năng liên kết của nguyên tử nguyên tố này với các nguyên tử nguyên tố khác.
IV. Bài tập vận dụng
Ví dụ 1: Xác định hóa trị của S trong các hợp chất sau: H2S và SO2.
Hướng dẫn giải:
- Trong hợp chất H2S:
H có hóa trị I, gọi hóa trị của S là a ta có:
2.I = 1.a ⇒ a = II.
Vậy trong hợp chất H2S thì lưu huỳnh có hóa trị II.
- Trong hợp chất SO2:
O có hóa trị II, gọi hóa trị của S là b, ta có:
1.b = 2.II ⇒ b = IV.
Vậy trong hợp chất SO2 thì lưu huỳnh có hóa trị IV.
Ví dụ 2: Biết trong công thức hóa học K2SO4 thì K có hóa trị I. Hãy xác định hóa trị của nhóm (SO4).
Hướng dẫn giải:
Gọi hóa trị của nhóm (SO4) là a.
Theo quy tắc hóa trị ta có: 2.I = 1.a ⇒ a = II.
Vậy nhóm (SO4) có hóa trị II.
Ví dụ 3. Tính hóa trị của C trong hợp chất CO2 và CO.
*CO2
Theo quy tắc hóa trị ta có: 1 . a = 2 . II
=> a = IV
Vậy C có hóa trị II trong hợp chất CO2
*CO
Theo quy tắc hóa trị: 1 . a = 1 . II
=> a = II
Vậy C có hóa trị II trong hợp chất CO
Ví dụ 4: Tìm hóa trị của Nito trong N2O5
Theo quy tắc hóa trị: 2 . a = 5. II
=> a = 10 / 2 = V
Vậy N có hóa trị V trong N2O5
Ví dụ 5: Tìm hóa trị của Fe trong FeSO4 và Fe2(CO3)3 với SO4 (II), CO3 (II)
*Fe2(CO3)3
Theo quy tắc hóa trị: 2 . a = 3 . II
=> a = 6 / 2 = III
Vậy Fe có hóa trị III trong Fe2(CO3)3
*FeSO4
Theo quy tắc hóa trị: 1 . a = 1 . II
=> a = II
Vậy Fe có hóa trị II trong hợp chất FeSO4
V. Bài ca hóa trị số 1 cơ bản
Bao gồm những chất phổ biến hay gặp:
Kali, Iot, Hiđro
Natri với Bạc, Clo một loài
Có hóa trị I bạn ơi
Nhớ ghi cho rõ kẻo rồi phân vân
Magie, Chì, Kẽm, Thủy ngân
Canxi, Đồng ấy cũng gần Bari
Cuối cùng thêm chú Oxi
Hóa trị II ấy có gì khó khăn
Bác Nhôm hóa trị III lần
Ghi sâu trí nhớ khi cần có ngay
Cacbon, Silic này đây
Là hóa trị IV không ngày nào quên
Sắt kia kể cũng quen tên
II, III lên xuống thật phiền lắm thay
Nitơ rắc rối nhất đời
I, II, III, IV khi thì là V
Lưu huỳnh lắm lúc chơi khăm
Lúc II, lúc VI khi nằm thứ IV
Photpho nói tới không dư
Nếu ai hỏi đến thì ừ rằng V
Bạn ơi cố gắng học chăm
Bài ca hóa trị suốt năm rất cần
*Bài ca hóa trị số 2 chi tiết.
Hidro (H) cùng với Liti (Li)
Natri (Na) cùng với Kali (K) chẳng rời
Ngoài ra còn Bạc (Ag) sáng ngời
Chỉ mang hóa trị I thôi chớ nhầm
Riêng Đồng (Cu) cùng với Thuỷ ngân (Hg)
Thường II ít I chớ phân vân gì
Đổi thay II, IV là Chì (Pb)
Điển hình hóa trị của Chì (Pb) là II
Bao giờ cùng hoá trị II
Là Oxi (O), Kẽm(Zn) chẳng sai chút gì
Ngoài ra còn có Canxi (Ca)
Magie (Mg) cùng với Bari (Ba) một nhà
Bo (B), Nhôm (Al) thì hóa trị III
Cacbon (C), Silic (Si), Thiếc (Sn) là IV thôi
Thế nhưng phải nói thêm lời
Hóa trị II vẫn là nơi đi về
Sắt (Fe) II toan tính bộn bề
Không bền nên dễ biến liền sắt III
Photpho (P) III ít gặp mà
Photpho (P) V chính người ta gặp nhiều
Nitơ (N) hóa trị bao nhiêu?
I, II, III, IV phần nhiều tới V
Lưu huỳnh (S) lắm lúc chơi khăm
Khi II lúc IV, VI tăng tột cùng
Clo Iot lung tung
II III V VII thường thì I thôi
Mangan (Mn) rắc rối nhất đời
Đổi từ I đến VII thời mới yên
Hoá trị II cũng dùng nhiều
Hoá trị VII cũng được yêu hay cần
Bài ca hóa trị thuộc lòng
Viết thông công thức đề phòng lãng quên
Học hành cố gắng cần chuyên
Siêng ôn chăm luyện tất nhiên nhớ nhiều.
-------------------------------------------
Như vậy VnDoc đã giới thiệu các bạn tài liệu Hóa trị là gì? Cách xác định hóa trị của một nguyên tố? Mời các bạn tham khảo thêm tài liệu: Chuyên đề Hóa học 8, Giải bài tập Hóa học 8, Giải SBT Hóa 8, Trắc nghiệm Hóa học 8, Tài liệu học tập lớp 8









