Phản ứng cộng H2 của Alkene
Chuyên đề Hóa học lớp 11: Phản ứng cộng H2 của Anken được VnDoc sưu tầm và giới thiệu tới các bạn học sinh cùng quý thầy cô tham khảo. Nội dung tài liệu sẽ giúp các bạn học sinh học tốt môn Hóa học lớp 11 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết: Phản ứng cộng H2 của Anken
I. Phương pháp giải bài tập phản ứng cộng H2 của Anken
CnH2n + H2 → CnH2n+2
+ Tỉ lệ phản ứng luôn là 1:1
+ Khối lượng trước và sau phản ứng luôn bằng nhau
+ Số mol sau phản ứng luôn giảm (vì mất H2) → nH2 p/ứ = nđ - ns
II. Ví dụ bài tập minh họa
Bài 1: Hỗn hợp khí X gồm H2 và một anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất. Tỉ khối của X so với H2 bằng 9,1. Đun nóng X có xúc tác Ni, sau khi phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Y không làm mất màu nước brom; tỉ khối của Y so với H2 bằng 13. Tìm công thức cấu tạo của anken.
Hướng dẫn giải
Gọi số mol hổn hợp X là 1 mol
Ta có M ̅X = 9,1. 2 = 18,2 → mX = 18,2. 1 = 18,2 g = mY
Mà M ̅Y = 13. 2 = 26 → nY = 18,2/26= 0,7 mol
→ nH2 pư = 1 – 0,7 = 0,3 mol = nanken → nH2 bđ = 0,7 mol
Manken = (18,2-0,7.2)/0,3 = 14n → n = 4 → CTPT của anken là C4H8
Anken có khả năng cộng HBr cho sản phẩm hữu cơ duy nhất
=> CTCT của anken là: CH3-CH=CH-CH3.
Bài 2: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Tính hiệu suất của phản ứng hiđro hoá?
A. 20%. B. 25%. C. 50%. D. 40
Hướng dẫn giải
Ta có : M ̅X = 4. 3,75 = 15
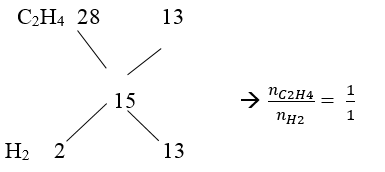
Vậy hiệu suất tính theo anken hoặc H2 củng được
Giả sử: nX = 1mol → mX = 15. 1 = 15 g = mY
Mà M ̅Y = 5. 4 = 20 → nY = 15/20 = 0,75 mol → nH2 pư = 1 – 0,75 = 0,25 mol
→ H = 0,25/0,5.100% = 50 %
Bài 3: Dẫn 3,36 lít hỗn hợp X gồm 2 anken là đồng đẳng kế tiếp vào bình nước brom dư, thấy khối lượng bình tăng thêm 7,7 gam. Tìm CTPT của 2 anken?
Hướng dẫn giải
Số mol hỗn hợp X là: nX = 3,36/22,4 = 0,15 mol
Phương trình phản ứng:
CnH2n + Br2 → CnH2nBr2
Khối lượng bình brom tăng là khối lượng của 2 anken:mX = 7,7 gam
=> M ̅X = mX/nX = 7,7/0,15 = 154/3 => n ̅ = 3,67.
Vậy CTPT của 2 anken kế tiếp là: C3H6 và C4H8
Bài 4: Cho 4,48 lit hỗn hợp X gồm etan, propan và propen qua dung dịch brom dư, thấy khối lượng bình brom tăng 4,2 gam. Lượng khí còn lại thoát ra khỏi dung dịch đem đốt cháy hoàn toàn thu được 6,48 gam nước. Tính % thể tích các chất có trong hỗn hợp.
Đáp án hướng dẫn giải
Số mol hỗn hợp X là: nX = 4,48/22,4 = 0,2 mol
Khối lượng bình brom tăng là khối lượng của propen: mpropen = 4,2 gam
=> npropen = 4,2/ 42 = 0,1 mol
Phương trình phản ứng: C3H6 + Br2 → C3H6Br2
Khí thoát ra gồm: C2H6 và C3H8.
Phương trình phản ứng đốt cháy C2H6 và C3H8
C2H6 + 7/2O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 3H2O
\(\overset{t^{\circ } }{\rightarrow}\) 2CO2 + 3H2O
C3H8 + 5O2 ![]() \(\overset{t^{\circ } }{\rightarrow}\) 3CO2 + 4H2O
\(\overset{t^{\circ } }{\rightarrow}\) 3CO2 + 4H2O
nH2O = 6,48/18 = 0,36 mol
Gọi số mol của etan và propan lần lượt là x và y mol
Ta có x + y = 0,2 – 0,1 = 0,1 (1); 3x + 4 y = 0,36 (2)
Từ (1), (2) => x = 0,04 và y = 0,06.
Phần trăm thể tích mỗi khí trong hỗn hợp ban đầu là:
%Vetan = 0,04/0,2.100% = 20%;
%Vpropan = 0,06/0,2.100% = 30%;
%Vpropen = 0,1/0,2.100% = 50%
Với chuyên đề Phản ứng cộng H2 của Anken chúng ta có thể nắm rõ các phản ứng hóa học, các tính chất thường gặp trong phản ứng cộng H2 của Anken.
Bài 5: Hỗn hợp X gồm 3 khí C3H4, C2H2 và H2 cho vào bình kín dung tích 8,96 lít (đktc) chứa bột Ni, nung nóng bình một thời gian thu được hỗn hợp khí Y. Biết tỉ khối của X so với Y là 0,75. Số mol H2 tham gia phản ứng là
A. 0,75 mol
B. 0,30 mol
C. 0,10 mol
D. 0,60 mol
Đáp án hướng dẫn giải
nX = 0,4 mol
Ta có: dX/Y= MY=nY/nX = nY/0,4 = 0,75 ⇒ nY = 0,3 (mol)
=> nH2phản ứng = ngiảm = nX – nY = 0,4 – 0,3 = 0,1 mol
Bài 6: Hỗn hợp khí X gồm H2 và C2H4 có tỉ khối so với He là 3,75. Dẫn X qua Ni nung nóng, thu được hỗn hợp khí Y có tỉ khối so với He là 5. Hiệu suất của phản ứng hiđro hoá là:
A. 25%
B. 20%
C. 50%
D. 40%
Đáp án hướng dẫn giải
MX = 15. Áp dụng quy tắc đường chéo => nC2H4 = nH2
Ở đây chúng ta giải sử số mol của C2H4 là 1 mol: nC2H4 = nH2 = 1 mol
Phương trình phản ứng
H2 + C2H4 → C2H6
Ban đầu 1 → 1
Phản ứng x → x → x
Căn bằng (1 – x) (1 – x) x
=> nY = (2 – x)
Bảo toàn khối lượng: mX = mY => 15.2 = 20.(2 – x)
=> x = 0,5 mol => H% = 50%
Bài 7: Cho hỗn hợp X gồm C2H4 và H2 có tỉ khối = 4,25. Dẫn X qua Ni nung nóng (H = 75%) thu được hỗn hợp Y. Tính tỉ khối của Y so với H2.
A. 5,23
B. 10,46
C. 5,5
D. 6,0
Đáp án hướng dẫn giải
Giả sử lấy 1 mol hỗn hợp X.
Gọi x, y lần lượt là số mol của C2H4, H2
=> x + y = 1 (1)
MX = (28x+2y)/(x+y) = 4,25.2 (2)
Từ (1) và (2) => x = 0,25 mol; y = 0,75 mol
C2H4 + H2 → C2H6
=> hiệu suất phản ứng tính theo C2H4
=> nC2H4 phản ứng = nhỗn hợp khí giảm = 0,25.0,75 = 0,1875 mol
=> nY = 1 – 0,1875 = 0,8125 mol
Áp dụng công thức:
MX/MY = nY/nX => 1.8,5/0,8125 = 10,46
=> dY/H2 = 5,23
.......................................
Mời các bạn tham khảo thêm tài liệu liên quan:
- Bài tập xác định tên nguyên tố kim loại hóa học 11
- Bài tập lập công thức phân tử hợp chất hữu cơ
- Bài tập tự luận môn Hóa học lớp 11 - Chương 4: Đại cương về hóa học hữu cơ









