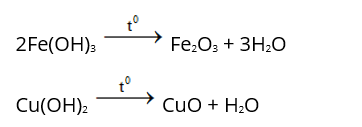Bazơ nào bị nhiệt phân hủy?
Chúng tôi xin giới thiệu bài Bazơ nào bị nhiệt phân hủy? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Bazơ nào bị nhiệt phân hủy?
Câu hỏi: Bazơ nào bị nhiệt phân hủy? Viết phương trình hóa học minh họa?
- Bazơ không tan như Cu(OH)2, Fe(OH)2, Fe(OH)3, Al(OH)3,… bị nhiệt phân hủy tạo thành oxit và nước.
1. Oxit là gì?
- Oxit là hợp chất của 2 nguyên tố, trong đó có một nguyên tố là oxi.
Ví dụ:
Cacbon dioxit (CO2), lưu huỳnh dioxit (SO2), diphopho pentaoxit (P2O5)…
Sắt (III) oxit (Fe2O3), đồng (II) oxit (CuO) , canxi oxit (CaO)…
2. Công thức của Oxit
- Theo quy tắc hóa trị, ta có: n.x = II.y
3. Phân loại oxit
Oxit được chia thành 2 loại chính là oxit axit và oxit bazo.
Oxit axit
- Oxit axit thường là oxit của phi kim, khi cho oxit tác dụng với nước thì thu được một axit tương ứng.
- Ví dụ:
+ CO2: axit tương ứng là axit cacbonic H2CO3
+ SO2: axit tương ứng là axit sunfuric H2SO4
+ P2O5: axit tương ứng là axit phophoric H3PO4
- Một vài tính chất của Oxit axit như sau:
+ Tính tan: Đa số các oxit axit khi hoà tan vào nước sẽ tạo ra dung dịch axit trừ SiO2:
Na2O + H2SO4 → Na2SO4 + H2O
FeO + HCl → FeCl2 + H 2OCuO + H2SO4 → CuSO4 + H2O
+ Tác dụng với oxit bazơ tan: Oxit axit tác dụng với oxit bazơ tan sẽ tạo muối:
SO3 + CaO → CaSO4
P2O5 +3Na2O → 2Na3PO4
+ Tác dụng với bazơ tan: Tùy vào tỉ lệ mol giữa oxit axit và bazơ phản ứng sẽ cho ra nước + muối trung hòa, muối axit hay hỗn hợp 2 muối:
Gốc axit tương ứng có hoá trị II:
– Đối với kim loại trong bazơ có hóa trị I:
Tỉ lệ mol B: OA là 1:
NaOH +SO2 → NaHSO3 (Phản ứng tạo muối axit)
Tỉ lệ mol B: OA là 2:
2KOH +SO3 → K2SO3 +H2O (Phản ứng tạo muối trung hòa)
– Đối với kim loại trong bazơ có hóa trị II:
Tỉ lệ mol OA: B là 1:
CO2 +Ca(OH)2 → CaCO3 (Phản ứng tạo muối trung hoà)
Tỉ lệ mol OA: B là 2:
SiO2 + Ba(OH)2 → BaSiO3 (Phản ứng tạo muối axit)
Đối với axit có gốc axit hóa trị III:
– Đối với kim loại có hóa trị I:
Tỉ lệ mol B: OA là 6:
P2O5 + 6NaOH → 2Na2HPO4 +H2O
Tỉ lệ mol B: OA là 4:
P2O5 +4NaOH -> 2NaH2PO4 +H2O
Tỉ lệ mol B: OA là 2:
P2O5 + 2NaOH +H2O → 2NaH2PO4
Oxit bazơ
- Oxit bazơ thường là oxit của kim loại và tương ứng với một bazơ.
- Ví dụ:
+ CaO: bazơ tương ứng là canxi hidroxit Ca(OH)2
+ CuO: bazơ tương ứng là đồng hidroxit Cu(OH)2
+ Fe2O3: bazơ tương ứng là Fe(OH)3
+ Na2O : bazơ tương ứng là NaOH
- Một vài tính chất của Oxit bazơ như sau:
+ Tác dụng với nước: Chỉ có oxit bazơ của kim loại kiềm và kiềm thổ là tác dụng với nước. Những oxit bazơ tác dụng với nước và do đó cũng tan được trong nước là: Na2O, K2O, CaO, BaO, Li2O, Rb2O, Cs2O, SrO.
Công thức: R2On + nH2O —> 2R(OH)n (n là hóa trị của kim loại R).
R(OH)n tan trong nước, dung dịch thu được ta gọi chung là dung dịch bazơ hay dung dịch kiềm (dung dịch bazơ tan). Các dung dịch bazơ này thường làm giấy quì tím chuyển sang màu xanh và làm phenolphtalein từ không màu chuyển sang màu hồng.
+ Tác dụng với axit: Hầu hết các oxit bazơ tác dụng với axit (Thường là HCl hoặc H2SO4) tạo thành muối và nước.
Công thức: Oxit bazơ + Axit —> Muối + H2O
+ Tác dụng với oxit axit: Một số oxit bazơ tác dụng với oxit axit tạo thành muối. Thông thường đó là các oxit tác dụng được với nước (tan được trong nước).
Công thức: Oxit bazơ + Oxit axit —> Muối
- Ngoài ra, còn có oxit lưỡng tính và oxit trung tính
+ Oxit lưỡng tính: là oxit có thể tác dụng với Axit hoặc bazơ tạo ra muối và nước. Ví dụ: Al2O3, ZnO
+ Oxit trung tính: là oxit không phản ứng với nước để tạo ra bazơ hay axit nhưng oxit này không phản ứng với bazơ hay axit để tạo muối. Ví dụ: Cacbon monoxit, Nitơ monoxit,..
4. Cách gọi tên oxit
- Công thức chung cho tên gọi của một axit là:
+ Tên oxit = Tên nguyên tố + oxit
- Ví dụ:
+ K2O: Kali oxit
+ NO: Nito oxit
- Với kim loại có nhiều hóa trị:
+ Tên oxit = Tên kim loại (kèm theo hóa trị) + oxit
- Ví dụ:
+ FeO: sắt (II) oxit
+ Fe2O3: sắt (III) oxit
- Với phi kim có nhiều hóa trị:
+ Tên oxit = (tiền tố chỉ số nguyên tử) Tên phi kim + (tiền tố chỉ số nguyên tử) oxit
- Các tiền tố trong hóa học (tiếp đầu ngữ):
+ Mono: nghĩa là 1
+ Đi: nghĩa là 2
+ Tri: nghĩa là 3
+ Tetra: nghĩa là 4
+ Penta: nghĩa là 5
+ Hexa: nghĩa là 6
+ Hepta: nghĩa là 7
+ Octa: nghĩa là 8
+ Nona: nghĩa là 9
+ Deca: nghĩa là 10
- Ví dụ:
+ CO: cacbon monooxit (thường gọi đơn giản là cacbon oxit)
+ CO2: cacbon dioxit (tên thường gọi là khí cacbonic)
+ SO3: lưu huỳnh trioxit (tên thường gọi là khí sunfurơ)
+ P2O3: diphotpho trioxit
+ P2O5: diphopho pentaoxit
5. Các phản ứng của oxit
- Phản ứng với nước
+ Oxide acid phản ứng với nước tạo thành dung dịch acid (trừ SiO2).
+ Ví dụ:
SO3 + H2O → H2SO4
P2O5 + 3H2O → 2H3PO4
- Một số oxide base phản ứng với nước tạo thành base. Chỉ có các Oxide base của kim loại kiềm (Li, Na, K, Rb, Cs, Fr) và một số kim loại kiềm thổ (Ca, Sr, Ba, Ra) kết hợp với nước sẽ tạo thành base tan
+ Ví dụ:
CaO + H2O → Ca(OH)2
ВаО + H2O → Ba(ОН)2
- Phản ứng với acid
+ Oxide base phản ứng với acid để tạo thành muối và nước
Ví dụ: 3CaO + 2H3PO4→ Ca3(PO4)2 + 3H2O
- Phản ứng với base
+ Oxide acid phản ứng với base để tạo thành muối và nước.
Vi dụ: SO3 + 2NaOH → Na2SO4 + H2O
+ Oxide lưỡng tính có thể phản ứng với base tạo thành muối và nước.
Ví dụ: Al2O3 + 2NaOH → 2NaAlO2 + H2O
- Phản ứng với oxide
+ Các oxide Li2O, K2O, BaO, CaO, Na2O có thể tác dụng với oxide acid tạo thành muối
+ Ví dụ:
CaO + CO2 → CaCO3
BaO + CO2 → BaCO3
-------------------------------
Ngoài Bazơ nào bị nhiệt phân hủy? đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.