Hoàn thành phương trình hóa học: Ca(OH)2 + NaHCO3
Hoàn thành phương trình hóa học: Ca(OH)2 + NaHCO3 được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hoàn thành phương trình hóa học Ca(OH)2 + NaHCO3
Câu hỏi: Hoàn thành phương trình hóa học Ca(OH)2 + NaHCO3
Trả lời:
|
Ca(OH)2 |
+ |
2NaHCO3 |
→ |
CaCO3 |
+ |
2H2O |
+ |
Na2CO3 |
|
canxi hidroxit hoặc tôi vôi |
|
natri hidrocacbonat |
|
canxi cacbonat |
|
nước |
|
natri cacbonat |
|
(dung dịch) |
|
(rắn) |
|
(kt) |
|
(lỏng) |
|
|
|
(không màu) |
|
|
|
(trắng) |
|
(không màu) |
|
|
- Điều kiện phản ứng: không có
- Hiện tượng phản ứng: kết tủa trắng (CaCO3)
I. Vôi tôi Ca(OH)2 là gì?
- Vôi tôi hay Canxi hidroxit Ca(OH)2 trong điều kiện bình thường nó là chất rắn dạng bột mềm màu trắng với điểm nóng chảy của Ca(OH)2 là khoảng 580oC, chúng không có mùi và rất khó bắt cháy. Bột Canxi hidroxit tan ít trong nước, tan nhiều trong dung dịch hữu cơ và vô cơ như Glycerol, axit nhưng đối với rượu thì lại không thể tan được.
- Vôi tôi bao gồm các dạng như:
+ Vôi sữa: Đây là dung dịch Ca(OH)2 chưa lọc, có thể chứa vẩn hạt Canxi hidroxit rất mịn trong nước.
+ Nước vôi trong: Đây là dung dịch Ca(OH)2 sau khi lọc bỏ cặn rắn sẽ thu được nước Ca(OH)2 trong suốt.
II. Tính chất vật lý của Ca(OH)2
- Ca(OH)2 là chất rắn màu trắng, ít tan trong nước. Khi tan tạo thành dung dịch canxi hyđroxit.
- Trong tự nhiên nó tồn tại trong một loại khoáng chất là portlandite.
- Không mùi, dễ bắt cháy.
- Nhiệt độ nóng chảy là 580oC (853oK).
- Phân tử gam là 74,093 g/mol.
III. Tính chất hóa học của Ca(OH)2
- Dung dịch Ca(OH)2 có có tính bazơ mạnh. Mang đầy đủ tính chất của bazơ:
Tác dụng với axit:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Tác dụng với muối:
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
Tác dụng với oxit axit:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Chú ý: Khi sục từ từ khí CO2 tới dư vào dung dịch Ca(OH)2 thì:
+ Ban đầu dung dịch vẩn đục:
Ca(OH)2 + CO2 → CaCO3↓ + H2O
+ Sau đó kết tủa tan dần và dung dịch trong suốt:
CO2 + H2O + CaCO3 → Ca(HCO3)2
IV. Cách điều chế Canxi hidroxit
Một số phương pháp chính được sử dụng để điều chế vôi tôi – Canxi hidroxit:
- Hòa tan Canxi vào nước
Ca + H2O → Ca(OH)2
- Sử dụng đất đèn CaC 2 (sản xuất trong công nghiệp) trộn lẫn với nước theo tỷ lệ thích hợp. Sản phẩm được tạo ra là Actylen dùng trong hàn các vật liệu kim loại và vôi tôi.
CaC2 + 2H2O → C2H2 + Ca(OH)2
- Dùng đá vôi Canxi cacbonat CaCO3 bỏ vào lò nung lên thành vôi sống Canxi oxit CaO:
CaCO3 + Q(nhiệt lượng) → CaO + CO2
Thả CaO vào nước ta được Ca(OH)2 hay còn gọi là vôi tôi dùng trong xây dựng để trộn lẫn với cát, xi măng, nước tạo thành hỗn hợp vữa làm chất kết dính.
CaO + H2O → Ca(OH)2
V. Ứng dụng của Ca(OH)2
1. Tác dụng của canxi hydroxit
- Chất kết bông trong xử lý nước, nước thải và cải tạo độ chua của đất.
- Thành phần của nước vôi, vữa trong xây dựng.
- Thay thế cho Natri hiđroxit trong một số loại hóa, mỹ phẩm uốn tóc của người Mỹ gốc Phi.
- Trong một số loại thuốc làm rụng lông.
- Thuốc thử hóa học
- Trong dạng bột nhão có tác dụng kháng vi trùng để điều trị sâu răng
- Trong nông nghiệp: Dùng để khử chua đất trồng.
2. Tác hại của canxi hydroxit
- Cơ thể con người hấp thụ quá mức canxi hydroxit có thể gây ra các triệu chứng nguy hiểm như khó thở, chảy máu trong , tê liệt cơ, hạ huyết áp, làm tăng độ pH của máu và tổn thương các cơ quan nội tạng.
- Bụi canxi hydroxit hoặc các giọt lơ lửng có tác dụng kích thích màng nhầy, có thể gây hắt hơi và ho, và giống như kiềm có thể xà phòng hóa chất béo, hấp thụ nước từ da, hòa tan protein, kích thích và ăn mòn các mô. Hít phải bụi vôi có thể gây viêm phổi.
VI. Bài tập ví dụ
Bài 1. Thổi V lít khí CO2 (đktc) vào 100ml dd Ca(OH)2 1M thu được 6g kết tủa. Lọc kết tủa đun nóng dd lại thấy có kết tủa nữa. Tìm V?
Dung dịch sau phản ứng đun nóng có xuất hiện thêm ↓ => có Ca(HCO3)2 tạo thành
BTNT Ca: 0,1 = 0,06 + nCa(HCO3)2 => nCa(HCO3)2 = 0,04 mol
nCO2 = nCaCO3 + 2*nCa(HCO3)2 = 0,14 mol
VCO2 = 3,136 lít
Bài 2. Sục 4,48 lít khí CO2 (đktc) vào 500ml dd NaOH 0,1 M và Ba(OH)2 0,2M tính m kết tủa thu được?
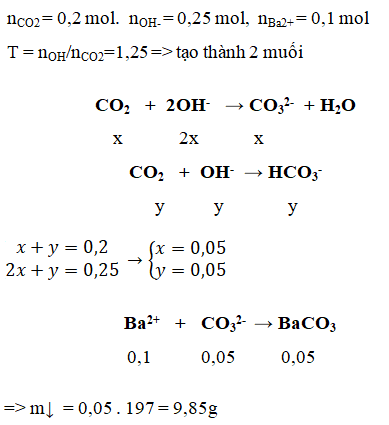
-------------------------------
Ngoài Hoàn thành phương trình hóa học: Ca(OH)2 + NaHCO3 đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









