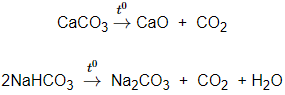Bản tường trình thực hành tính chất hóa học của phi kim và hợp chất của chúng
Bản tường trình thực hành tính chất hóa học của phi kim và hợp chất của chúng được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Bản tường trình thực hành tính chất hóa học của phi kim
Lý thuyết về phi kim
1. Tinh chất hóa học của phi kim
a, Tác dụng với kim loại
- Phi kim tác dụng với kim loại tạo thành muối hoặc oxit
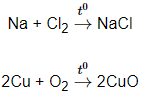
b, Tác dụng với hiđro
- Phi kim tác dụng với hiđro tạo thành hợp chất khí
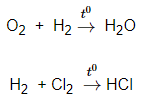
c, Tác dụng với oxi:
- Tạo thành oxit axit
![]()
2. Tính chất hóa học của Cacbon
- Tác dụng với oxi tạo thành cacbonđioxit
![]()
- Tác dụng với oxit kim loại
![]()
3. Tính chất hóa học của muối cacbonat
Tác dụng với axit mạnh hơn axit cacbonic và tạo thành muối mới và giải phóng khí CO2.
Na2CO3 + 2HCl → NaCl + CO2 + H2O
Tác dụng với dung dịch bazơ tạo thành muối cacbonat không tan và bazơ mới
NaHCO3 + NaOH → Na2CO3 + H2O
Tác dụng với dung dịch muối tạo thành hai muối mới.
Na2CO3 + CaCl2 → CaCO3 + 2NaCl
Bị nhiệt phân hủy
Tiến hành thí nghiệm
Thí nghiệm 1: Cacbon khử đồng (II) oxit ở nhiệt độ cao
– Hiện tượng: Hỗn hợp CuO + C đun nóng và có sự chuyển đổi từ màu đen → màu đỏ.
Dung dịch nước vôi trong vẩn đỏ.
– Giải thích: PTHH
2CuO + C → 2Cu + CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Thí nghiệm 2: Nhiệt phân muối NaHCO 3
– Hiện tượng: Lượng muối NaHCO3 giảm dần → NaHCO3 bị nhiệt phân.
Phần miệng ống nghiệm có hơi nước ngưng đọng → có nước tạo ra.
Dung dịch Ca(OH)2 bị vẩn đục.
– Giải thích: PTHH
2NaHCO3 → Na2CO3 + H2O + CO2
Ca(OH)2 + CO2 → CaCO3 + H2O
Thí nghiệm 3: Nhận biết muối cacbonat và muối clorua
Các phương án nhận biết 3 chất: NaCl, Na2CO3, CaCO3
– Phản ứng với dung dịch axit HCl:
+ Không có khí thoát ra → NaCl
+ Có khí thoát ra →Na2CO3, CaCO3
– Tính tan trong nước H2O
+ Tan: Na2CO3
+ Không tan: CaCO3
Thao tác thí nghiệm:
– Đánh số các lọ hóa chất và ống nghiệm.
– Lấy 1 thìa mỗi chất vào ống nghiệm có số tương ứng.
– Nhỏ 2ml dd HCl vào mỗi ống nghiệm:
+ Nếu không có khí thoát ra → NaCl.
+ Có khí thoát ra →Na2CO3, CaCO3
– Lấy một thìa hóa chất trong 2 lọ còn lại cho vào ống nghiệm.
– Cho 2ml nước cất, lắc nhẹ:
+ Chất rắn tan → nhận ra Na2CO3
+ Chất rắn không tan → nhận ra CaCO3
Mẫu bản tường trình
Họ và tên: ......................................................................................................
Lớp: ......................................................................................................
Báo cáo thực hành hóa 9 bài 33 :
Tính chất hóa học của phi kim và hợp chất của chúng
Thí nghiệm 1: Cacbon khử đồng (II) oxit ở nhiệt độ cao
- Dụng cụ hóa chất:
- Dụng cụ: ống nghiệm, đèn cồn, cốc thủy tinh, giá đỡ, ống dẫn khí,…
- Hóa chất: hỗn hợp đồng (II) oxit và cacbon, dung dịch Ca(OH)2,..
Cách tiến hành:
- Lấy một ít (bằng hạt ngô) hỗn hợp đồng (II) oxit và cacbon (bột than gỗ) vào ống nghiệm.
- Đun nóng đáy ống nghiệm bằng ngọn lửa đèn cồn.
Hiện tượng - giải thích:
Sau khi đun nóng một thời gian, ta thấy phần đáy ống nghiệm bột màu đen (CuO + C) chuyển sang màu đỏ (Cu).
2CuO + C → 2Cu + CO2
Khí CO2 tạo thành được dẫn vào dung dịch Ca(OH)2 nên trong cốc chứa bị vẩn đục trắng:
CO2 + Ca(OH)2 → CaCO3 + H2O
Kết luận:
Cacbon có tính khử, có thể khử oxit kim loại thành kim loại.
Thí nghiệm 2: Nhiệt phân muối NaHCO 3
Dụng cụ hóa chất:
- Dụng cụ: ống nghiệm, đèn cồn, cốc , giá đỡ, ống dẫn khí,…
- Hóa chất: muối NaHCO3, dung dịch Ca(OH)2.
Cách tiến hành:
- Lấy một thìa nhỏ muối NaHCO3 vào ống nghiệm.
- Lắp dụng cụ như hình 3.16 trang 89
- Đun nóng đáy ống nghiệm bằng ngọn lửa đèn cồn.
Hiện tượng – giải thích:
Trên thành ống nghiệm xuất hiện những giọt nước đọng lại, vào ống nghiệm đựng dung dịch Ca(OH)2 thì xuất hiện vẩn đục:
2NaHCO3 Na2CO3 + CO2 + H2O
CO2 + Ca(OH)2 → CaCO3 + H2O
Kết luận:
Muối NaHCO3 khan không bền bởi nhiệt. Và bị phân hủy ra Na2CO3 và CO2, H2O
Thí nghiệm 3: Nhận biết muối cacbonat và muối clorua
- Có 3 lọ đựng 3 chất rắn ở dạng bột là NaCl, Na2CO3 và CaCO3. Hãy làm thí nghiệm nhận biết mỗi chất trong các lọ trên.
Dụng cụ hóa chất:
- Dụng cụ: ống nghiệm, kẹp gỗ, ….
- Hóa chất: 3 chất rắn ở dạng bột là NaCl, Na2CO3 và CaCO3, nước, dung dịch HCl.
Cách tiến hành:
- Hòa tan lần lượt từng chất rắn đã cho ở trên vào nước. Chất nào không tan trong nước là CaCO3 còn lại NaCl và Na2CO3 tan trong nước.
- Cho dung dịch hòa tan vừa thu được tác dụng với dung dịch HCl, chất nào tạo ra khí thì chất đó là Na2CO3 còn lại là NaCl:
Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
-------------------------------
Ngoài Bản tường trình thực hành tính chất hóa học của phi kim và hợp chất của chúng đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.