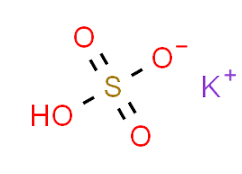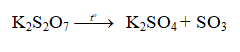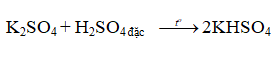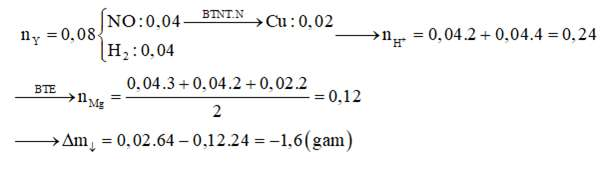Hoàn thành phương trình hóa học: Ba(HCO3)2 + KHSO4
Hoàn thành phương trình hóa học: Ba(HCO3)2 + KHSO4 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hoàn thành phương trình hóa học
Hoàn thành phương trình hóa học:
|
2KHSO4 |
+ |
Ba(HCO3)2 |
→ |
2H2O |
+ |
K 2SO4 |
+ |
2CO2 |
+ |
BaSO4 |
|
Kali hidro sunfat |
|
Bari Bicacbonat |
|
nước |
|
Kali sunfat |
|
Cacbon dioxit |
|
Bari sunfat |
|
Dung dịch |
|
Dung dịch |
|
|
|
Dung dịch |
|
khí |
|
Rắn |
- Điều kiện xảy ra phản ứng: nhiệt độ phòng
- Hiện tượng nhận biết: kết tủa trắng (BaSO4) và sủi bọt khí (CO2)
I. Lý thuyết KHSO4
1. Cấu tạo KHSO4
- Là muối của K với gốc hiđro sunfat HSO4.
- Công thức phân tử: KHSO4
- Công thức cấu tạo:
2. Tính chất vật lý của KHSO4
- Nguyên tử / Phân tử khối: 136.1688 (g/mol)
- Khối lượng riêng: 2245 (kg/m3)
- Màu sắc: màu trắng
- Trạng thái thông thường: chất rắn
- Nhiệt độ sôi: 300(oC)
- Nhiệt độ nóng chảy: 197(oC)
3. Tính chất hóa học
- Là 1 muối axit của ion trung tính K+ và ion HSO4 - vẫn còn khả năng phân li ra ion H+
=> Muối KHSO4 có tính axit mạnh tương đương với axit HCl loãng và KHSO4 loãng.
- Phương trình phân li: KHSO4 → K+ + HSO4-
- Làm đổi màu chất chỉ thị màu quỳ tím sang đỏ.
- Tác dụng với dung dịch bazơ (NaOH; KOH; Ca(OH)2; Ba(OH)2 ) → phản ứng trung hòa
KHSO4 + KOH → K2SO4 + H2O
KHSO4 + Ba(OH)2 → BaSO4 + K2SO4 + H2O
- Tác dụng với kim loại:
KHSO4 + Zn → ZnSO4 + K2SO4 + H2
KHSO4 + K → K2SO4 + H2
- Tác dụng với muối: (đk: sản phẩm phải có chất ít tan, bay hơi và axit mới yếu hơn axit ban đầu).
KHSO4 + Fe(NO3)2 → Fe2(SO4)3 + K2SO4 + NO + H2O
KHSO4 + K2CO3 → K2SO4 + KHCO3 (tỉ lệ mol 1:1)
KHSO4 + K2CO3 → K2SO4 + CO2 + H2O (tỉ lệ mol 2:1)
KHSO4 + BaCO3 → BaSO4 + K2SO4 + CO2 + H2O
KHSO4 + K2SiO3 → K2SO4 + H2SiO3
KHSO4 + BaCl2 → BaSO4 + KCl + HCl
- Phản ứng của 2 muối axit với nhau: (muối axit mạnh sẽ đóng vai trò là axit; muối axit yếu sẽ đóng vai trò là bazơ)
KHSO4 + KHCO3 → K2SO4 + CO2 + H2O
- Phản ứng nhiệt phân:
- Kali pirosunfat
4. Điều chế KHSO4
- KHSO4 được coi là sản phẩm phụ trong quá trình sản xuất HNO3 từ KNO3 và H2SO4 đặc:
- Dạng tinh khiết, điều chế bằng cách đun nóng hỗn hợp KHSO4; H2SO4 đặc đế khi thành khối trong suốt → làm lạnh chất lỏng → thu được tinh thể KHSO4:
- Cho muối KHCO3 tác dụng với H2SO4:
KHCO3 + H2SO4 → KHSO4 + CO2 + H2O
II. Bài tập vận dụng
Bài 1: Người ta hòa 216,55 gam hỗn hợp muối KHSO4 và Fe(NO3)3 vào nước dư thu được dung dịch A. Sau đó cho m gam hỗn hợp B gồm Mg, Al, Al2O3 và MgO vào dung dịch A rồi khuấy đều tới khi các phản ứng xảy ra hoàn toàn thấy B tan hết, thu được dung dịch C chỉ chứa các muối và có 2,016 lít hỗn hợp khí D có tổng khối lượng là 1,84 gam gồm 5 khí ở (đktc) thoát ra trong đó về thể tích H2, N2O, NO2 lần lượt chiếm 4/9,1/9 và 1/9. Cho BaCl2 dư vào C thấy xuất hiện 356,49 gam kết tủa trắng. Biết trong B oxi chiếm 64/205 về khối lượng. Giá trị đúng của m gần nhất với.
Giải:
- Tính số mol KHSO4 = BaSO4 = 1,53 mol
→ Fe(NO3)3 =0,035 mol
- Hai khí còn lại là NO và N2O, số mol là x, y.
- Lập hệ phương trình về tổng khối lượng và số mol tìm được x = 0,01 và y = 0,02.
- Bảo toàn N tính số mol NH4+ = 0,025 mol
- Bảo toàn H tính số mol H2O = 0,675 mol
- Bảo toàn O: 4nKHSO4 + nFe(NO3)3 + nO(B) = nH2O + nSO42- + nO(khí)
Suy ra nO(B) = 0,4 ⟶ mB = 6,4 : 64 / 205 = 20,5g
Câu 2: Nhúng thanh Mg vào dung dịch chứa KHSO4 và Cu(NO3)2, sau khi kết thúc các phản ứng thu được dung dịch X (không chứa ion NH4+) và 1,792 lít (đktc) hỗn hợp khí Y gồm NO và H2. Biết Y có tỷ khối hơi so với H2 là 8. Nhấc thanh Mg ra rồi cân lại thì thấy khối lượng thanh giảm m gam. Xem toàn bộ Cu sinh ra bám vào thanh Mg. Giá trị của m là:
-------------------------------
Ngoài Hoàn thành phương trình hóa học: Ba(HCO3)2 + KHSO4 đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.