Các tính chất vật lý của Benzen
VnDoc xin giới thiệu bài Các tính chất vật lý của Benzen được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Tính chất vật lý của Benzen
Câu hỏi: Nêu các tính chất vật lý của benzen?
Trả lời:
- Các hiđrocacbon thơm đều là chất lỏng hoặc rắn ở điều kiện thường, chúng có nhiệt độ sôi tăng theo chiều tăng của phân tử khối.
- Các hiđrocacbon thơm ở thể lỏng có mùi đặc trưng, không tan trong nước và nhẹ hơn nước, có khả năng hòa tan nhiều chất hữu cơ.
1. Benzen là gì?
Benzene là một hợp chất hữu cơ có công thức hoá học C6H6. Benzen là một hyđrocacbon thơm, trong điều kiện bình thường là một chất lỏng không màu, mùi dịu ngọt dễ chịu, dễ cháy. Benzen tan kém trong nước và rượu. Vì chỉ chứa carbon và hydro nên benzene là một hydrocarbon.
Benzen là thành phần tự nhiên của dầu thô và là một trong những hóa chất dầu cơ bản. Do các liên kết pi liên tục tuần hoàn giữa các nguyên tử carbon, benzen được phân loại là hydrocarbon thơm, [n] - annulene) thứ hai. Nó đôi khi được viết tắt là PhH. Benzen là một chất lỏng không màu và rất dễ cháy và có mùi thơm, nó tạo ra mùi thơm xung quanh các trạm xăng. Nó được sử dụng chủ yếu như một tiền chất để sản xuất các hóa chất có cấu trúc phức tạp hơn, chẳng hạn như ethylbenzene và cumene, trong đó hàng tỷ kg được sản xuất hàng năm. Vì benzen có số octan cao, các dẫn xuất thơm như toluene và xylene thường chiếm tới 25% xăng. Bản thân benzen đã bị giới hạn ở mức dưới 1% trong xăng vì nó là chất gây ung thư ở người. Hầu hết các ứng dụng phi công nghiệp cũng bị hạn chế vì lý do tương tự
2. Đồng đẳng, đồng phân và danh pháp của Benzen
Đồng đẳng
- Đồng đẳng của benzen bao gồm các hidrocacbon có 1 vòng benzen và nhánh no (gốc ankyl).
- Công thức chung dãy đồng đẳng của benzen: CnH2n-6 (n ≥ 6)
Ví dụ: C6H6; C7H8
Đồng phân
- Đồng phân gồm: Đồng phân vị trí nhóm ankyl trong vòng benzen và đồng phân mạch cacbon của nhánh.
+ Nếu 2 nhóm thế ở 2 C lân cận ta có đồng phân ortho (viết tắt o-) hoặc đánh số 1,2.
+ Nếu 2 nhóm thế cách nhau 1 nguyên tử cacbon (1 đỉnh tam giác) gọi là đồng phân meta (viết tắt m-) hoặc 1,3.
+ Nếu 2 nhóm thế ở 2 nguyên tử cacbon đối đỉnh gọi là đồng phân para (viết tắt p-) hoặc 1,4.
Ví dụ: Các đồng phân của diclobenzen (C6H4Cl2).
Danh pháp
Tên thông thường như: C6H5CH3 (toluen)
Tên thay thế: Gốc ankyl + benzen
Khi có 2 nhánh trở lên tên gọi sẽ bao gồm: Tên vị trí – tên nhánh + benzen
Ví dụ: C9H12 viết các đồng phân ankylbenzen, có 3 đồng phân vị trí ứng với công thức: CH3C6H4-C2H5
3. Tính chất vật lý của Benzen
Benzen nói riêng và hiđrocacbon thơm nói chung ở điều kiện thường đều là chất lỏng hoặc chất rắn, nhiệt độ sôi của các chất này tăng theo dần theo phân tử khối. Các hiđrocacbon thơm tồn tại ở thể lỏng trong điều kiện thường sẽ có những mùi đặc trưng, nhẹ hơn nước và không tan trong nước. Ngược lại, có thể làm dung môi hòa tan nhiều chất hữu cơ khác. Benzen (C6H6) chính là ví dụ điển hình.
4. Tính chất hóa học của Benzen
a, Phản ứng thế
- Phản ứng halogen hóa
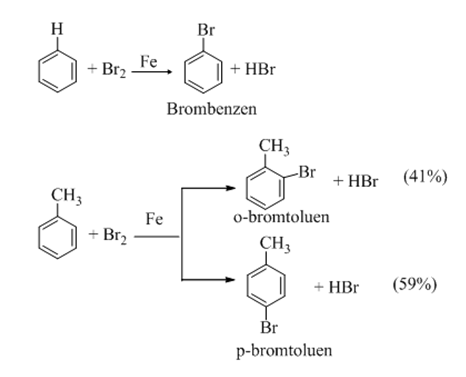
+ Khi có bột sắt, benzen tác dụng với brom khan tạo thành brombenzen và khí hiđro bromua.
+ Toluen phản ứng nhanh hơn benzen và tạo ra hỗn hợp hai đồng phân ortho và para.
+ Nếu không dùng Fe mà chiếu sáng (as) thì Br thế cho H ở nhánh.
- Nhóm C6H5CH2 gọi là nhóm benzyl, nhóm C6H5 gọi là nhóm phenyl.
b, Phản ứng nitro hóa
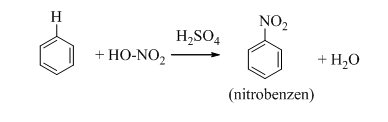
- Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen:
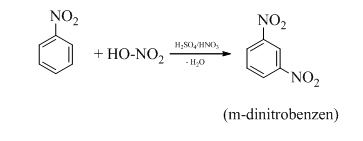
- Nitrobenzen tác dụng với hỗn hợp axit HNO3 bốc khói và H2SO4 đậm đặc đồng thời đun nóng thì tạo thành m-đinitrobenzen.
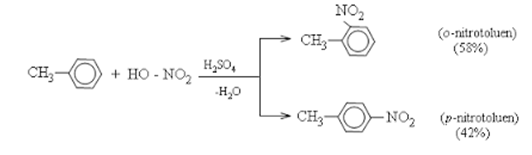
- Toluen tham gia phản ứng nitro hóa dễ dàng hơn benzen và tạo thành sản phẩm thế vào vị trí ortho và para:
c, Quy luật thế ở vòng benzen
+ Nếu vòng benzen đã có sẵn các nhóm −CH3,−OH,−NH2,−OCH3…, phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí ortho và para.
+ Nếu ở vòng benzen đã có sẵn nhóm −NO2 (hoặc các nhóm −COOH,−SO3H,−CHO…) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.

d, Phản ứng cộng
+ Benzen và ankylbenzen không làm mất màu dung dịch brom (không cộng với brom).
+ Benzen cộng với clo khi chiếu sáng:
C6H6+3Cl2→ (DK: as) C6H6Cl6
+ Benzen và ankylbenzen cộng với hiđro tạo thành xicloankan:
C6H6 + 3H2 → (DK: Ni,to) C6H12
e, Phản ứng oxi hóa
+ Benzen không tác dụng với KMnO4 (không làm mất màu dung dịch KMnO4).
+ Các ankylbenzen khi đun nóng với dung dịch KMnO4 thì chỉ có nhóm ankyl bị oxi hóa.
+ Các aren khi cháy trong không khí thường tạo ra nhiều muội than. Khi aren cháy hoàn toàn thì tạo ra CO2, H2O và tỏa nhiều nhiệt.
C6H6 + 15/2O2 → 6CO2 + 3H2O (ΔH = −3273 kJ)
Nhận xét: Benzen tương đối dễ tham gia phản ứng thế, khó tham gia phản ứng cộng và bền vững với các chất oxi hóa. Đó cũng là tính chất hóa học đặc trưng chung của các hiđrocacbon thơm nên được gọi là tính thơm.
-------------------------------
Ngoài Các tính chất vật lý của Benzen đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









