Benzen có làm mất màu dung dịch Brom không?
Chúng tôi xin giới thiệu bài Benzen có làm mất màu dung dịch Brom không? được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Benzen có làm mất màu dung dịch Brom không?
Câu hỏi: Benzen có làm mất màu dung dịch Brom không?
Trả lời:
Không.
Bởi vì: phân tử có cấu tạo vòng, trong đó có 3 liên kết đôi xen kẽ ba liên kết đơn.
I. Brom là gì?
1. Brom là gì?
Brom hay còn gọi là brôm, có ký hiệu hóa học là Br, thuộc nhóm Halogen. Đây là một chất lỏng bốc khói màu nâu đỏ ở nhiệt độ phòng và có thể dễ dàng bốc hơi để hình thành chất khí có màu tương tự.
2. Nguồn gốc
Brom được phát hiện độc bởi hai nhà hóa học là Carl Jacob Löwig cùng Antoine Jérôme Balard lần lượt vào năm 1825 và 1826. Balard chưng cất brom từ dung dịch tro tảo biển đã được bão hòa bằng clo. Löwing đã cô lập brom từ suối nước khoáng và tách brom ra bằng diethylether. Tuy Löwig phát hiện sớm hơn nhưng sự công bố các kết quả lại bị trì hoãn và Balard đã có công bố các kết quả trước.
3. Trạng thái tự nhiên
- Tồn tại ở dạng hợp chất, chủ yếu là muối bromua của kali, natri, magie.
- Bromua kim loại có trong nước biển, nước của 1 số hồ cùng với muối clorua.
II. Tính chất của brom
1. Tính chất vật lý
- Là chất lỏng màu đỏ nâu, dễ bay hơi, có mùi khó chịu và độc
- Nhiệt độ nóng chảy: 265,8 K
- Nhiệt độ sôi: 332,0 K
- Brom ít tan trong nước nhưng lại tan nhiều trong các dung môi hữu cơ như benzen, etanol, xăng,...
2. Tính chất hóa học
Tác dụng với kim loại
Sản phẩm tạo muối tương ứng
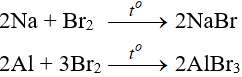
Tác dụng với hidro
![]()
Độ hoạt động giảm dần từ Cl → Br → I
Các khí HBr, HI tan vào nước tạo dung dịch axit.
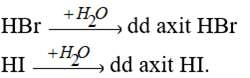
Về độ mạnh axit thì lại tăng dần từ HCl < HBr < HI.
Tính khử của Br2 , HBr
- Brom thể hiện tính khử khi gặp chất oxi hóa mạnh (như nước clo, …)
Br2 + 5Cl2 + 6H2O → 2HBrO3 (Axit bromic) + 10HCl
- Tính khử của HBr (ở trạng thái khí cũng như trong dd) mạnh hơn HCl. HBr khử được H2SO4 đặc thành SO2.
2HBr + H2SO4đ → Br2 + SO2 + 2H22O
- Dd HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dd HF và HCl không có phản ứng này):
4HBr + O2 → 2H2O + 2Br2
III. Điều chế
- Nguồn chính để điều chế brom là nước biển.
- Điều chế brom dựa trên sự oxi hóa ion Br-, chất oxi hóa là clo.
IV. Một số hợp chất của brom
Hidro bromua và axit bromhidric
- Ở nhiệt độ thường, HBr là chất khí, không màu, "bốc khói" trong không khí ẩm và rất dễ tan trong nước.
- Dung dịch HBr trong nước được gọi là dung dịch axitbromhiđric. Axitbromhiđric là một axit mạnh, mạnh hơn axit clohiđric.
- Tính khử:
HBr có tính khử mạnh hơn HCl, HBr khử được H2SO4 đặc thành SO2.
![]()
Dung dịch HBr không màu, để lâu trong không khí trở nên có màu vàng nâu vì bị oxi hóa (dung dịch HF và HCl không có phản ứng này):
![]()
Hợp chất chứa oxi của brom
- Axit hipobromo (HBrO) có tính bền, tính oxi hóa và tính axit kém HClO.
![]()
- Axit bromic (HBrO3).
- Axit pebromic (HBrO4).
Tương tự như clo, trong các hợp chất với oxi brom thể hiện số oxi hóa dương (+1, +3, +5, +7).
V. Ứng dụng của Brom là gì?
Ứng dụng rộng rãi trong dược phẩm, sản xuất thuốc nhuộm hay mực in và trong nhiếp ảnh để làm thuốc tráng hình
Sử dụng như một chất chống cháy với khả năng làm chất ngăn chặn hay làm chậm quá trình phát lửa do chất dẻo
Trong nông nghiệp: các hợp chất brom hữu cơ là nguyên liệu tạo ra thuốc trừ sinh vật gây hại, diệt sâu bọ, thậm chí cả các loài gặm nhấm.
Trong công nghiệp: Làm chất phụ gia xăng dầu. Tuy nhiên ứng dụng này đang dần ít đi. Ứng dụng trong khoan dầu: các hợp chất bromua dạng lỏng được dùng làm dung dịch khoan đặc biệt cho giếng khoan sâu và có áp suất cao
-------------------------------
Ngoài Benzen có làm mất màu dung dịch Brom không? đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








