Cấu tạo phân tử Etilen
Chúng tôi xin giới thiệu bài Cấu tạo phân tử Etilen được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cấu tạo phân tử Etilen
Câu hỏi: Nêu cấu tạo phân tử etilen?
Trả lời:
- Etilen có công thức cấu tạo:
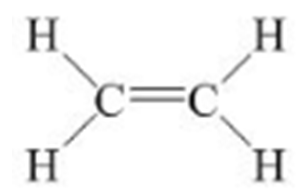
Viết gọn là: CH2=CH2
- Trong phân tử etilen C2H4, có một liên kết đôi giữa hai nguyên tử cacbon.
Chú ý: Trong liên kết đôi có một liên kết kém bền. Liên kết này dễ đứt ra trong các phản ứng hóa học.
A. Lý thuyết về etilen
1. Etilen là gì?
Ethylen, (tiếng Anh: ethylene, tên IUPAC: ethene) có công thức hóa học là CH2=CH2, là chất đầu tiên trong dãy đồng đẳng hydrocarbon alken. Đây là hợp chất hữu cơ được sản xuất nhiều nhất trên thế giới, khoảng hơn 150 triệu tấn vào năm 2016. Hydrat của ethylen là etanol.
2. Tính chất vật lý của Etilen
- Là chất khí, không màu, không mùi
- It tan trong nước.
- Nhẹ hơn không khí (dC2H4/kk = 28/29)
3. Tính chất hóa học của Etilen
Phản ứng oxi hóa
Khi etilen cháy hoàn toàn tạo ra CO2 cùng H2O và phản ứng tỏa nhiều nhiệt
C2H4 + 3O2 → 2CO2 + 2H2O
Phản ứng cộng
Tác dụng với dung dịch brom (làm đổi màu dung dịch Br, mất màu)
C2H4 + Br2 → C2H4Br2
- Phản ứng với clo
CH2 = CH2 + Cl2 → CH2=CH2Cl + HCl
- Phản ứng cộng hidro
C2H4 + H2 → C2H6
- Phản ứng cộng axit
CH2=CH2 + HCl (khí) → CH3CH2Cl
C2H4 + HBr → C2H5Br
- Phản ứng cộng nước (có điều kiện nhiệt độ và sự xúc tác của axit)
C2H4 + H2O → C2H5OH
Phản ứng trùng hợp
Ở trong điều kiện thích hợp, liên kết kém bền trong phân tử etilen bị đứt ra dẫn đến hiện tượng các phân tử etilen kết hợp lại với nhau tạo ra một chất có phân tử lượng rất lớn được gọi là polime.
….+ CH2=CH2 + CH2=CH2 +….→ ….- CH2– CH2 – CH2– CH2 -….
4. Ứng dụng của Etilen
- Ứng dụng của Ethylene trong công nghiệp như:
+ Dùng trong sản xuất bao bì
+ Vận chuyển
+ Ngành điện tử
+ Ngành dệt may
+ Nguyên liệu tạo ra chất phủ và chất kết dính
+ Nguyên liệu trong vật liệu xây dựng
+ Tham gia nhiều phản ứng tạo ra các hóa chất
+ Ứng dụng vào ngành hóa dầu
+ Ứng dụng dẫn xuất
- Đối với các ngành nông nghiệp:
+ Ethylene có khả năng làm tăng sự sinh trưởng của các tế bào thực vât
+ Gây kích thích sự nảy mầm, sinh trưởng của các loại cây trồng, cây cối
+ Tăng năng suất cây trồng, phục vụ các ngành nông nghiệp trồng trọt canh tác
+ Đặc biệt quen thuộc nhất đối với chúng ta là làm cây trái quả nhanh chín hơn thậm chí còn chín đều, ổn định hơn so với các phương pháp khác.
Dù đóng góp một phần không nhỏ đến đời sống con người và động – thực vật, song, chúng vẫn rất nguy hại nếu chúng ta không biết cách đối phó hay sử dụng C2H4 hay Etilen mà không hề có một kiến thức nào về nó.
5. Điều chế Etilen
+ Trong công nghiệp, etilen được sản xuất bằng cách tách hidro từ ankan tương ứng hoặc bằng phản ứng craking.
+ Trong phòng thí nghiệm, etilen được điều chế bằng phương pháp đun nóng etanol với axit sunfuric đậm đặc
CH3CH2OH → CH2=CH2 + H2O (H2SO4, to)
Tham khảo thêm các phản ứng hóa học khác của C2H4:
3C2H4 + 2KMnO4 + 4H2O → 3C2H6O2 + 2KOH + 2MnO2
C2H4 + 2Na → C2H4Na2
6. Etilen nguy hiểm như thế nào?
- Trước tiên thì khí ethene hoàn toàn ko độc nếu con người hít vào. Tuy nhiên, trong môi trường quá nhiều khí C2H4 sẽ gây ngạt thở do thiếu oxy.
- Theo tính chất vật lí – một chất ko màu ko mùi, vì thế rất khó phân biệt việc khí C2H4 đang tích tụ trong phòng kín hay ko.
- Hít quá nhiều khí C2H4 sẽ bị mất nhận thức, gây mê, và thậm chí tử vong vì ngạt thở. Ngoài ra lúc những bạn vô tình tiếp xúc C2H4 ở dạng lỏng mà ko với đồ bảo hộ sẽ gây tê và những mô phơi nhiễm sẽ bị đông cứng.
- Vì Etilen rất dễ bắt cháy, nên tuyệt đối ko để khí C2H4 lọt ra ngoài nơi đang với lửa hay sử dụng đồ gây nổ, cháy trong môi trường với C2H4.
- Những bình chứa C2H4 đều chứa áp lực cao, tránh trường hợp bình bị rò rỉ. lúc sử dụng bình với chứa Etilen phải thường xuyên rà soát.
7. Mua khí Etilen công nghiệp ở đâu?
Với những ứng dụng đa dạng của mình, khí etilen được sản xuất với số lượng lớn và lượng tiêu thụ cao (năm 2016: sản lượng tiêu thụ khí etilen lên đến 150 triệu tấn). Bạn có thể dễ dàng tìm mua khí etilen ở nhiều nơi trên thị trường với các quy cách đóng gói phù hợp với từng nhu cầu. Tuy nhiên, để đảm bảo chất lượng sản phẩm, giá thành cũng như an toàn khi sử dụng, cần lựa chọn những cơ sở uy tín, đã được kiểm định thực tế.
B. Bài tập luyện tập
Bài tập 1: Hãy nêu phương pháp hoá học loại bỏ khí etilen có lẫn trong khí metan để thu được metan tinh khiết.
Bài giải
Dẫn hỗn hợp khí qua bình đựng dung dịch brom dư, khí etilen phản ứng hết tạo thành đibrometan là chất lỏng ở trong dung dịch. Khí thoát ra là CH4.
CH2 = CH2 + Br2 → Br-CH2-CH2-Br
-------------------------------
Ngoài Cấu tạo phân tử Etilen đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









