Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư
Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hiện tượng quan sát được khi cho mẩu Magie vào ống nghiệm chứa axit HCl
Câu hỏi: Hiện tượng quan sát được khi cho mẩu Magie vào ống nghiệm chứa axit HCl dư là
- Mẩu Mg tan dần, không có bọt khí thoát ra
- Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu
- Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được có màu xanh lam
- Không xảy ra hiện tượng gì
Trả lời:
Đáp án đúng: B. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu
Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư là Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu.
Giải thích:
Khi cho mẩu magie vào ống nghiệm chứa axit HCl dư mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu :
Mg + 2HCl → MgCl2 + H2
Dung dịch MgCl2 thu được không có màu
I. Magie (Mg)
1. Khái niệm của Magnesium là gì?
Trong bảng tuần hoàn, Magnesium là nguyên tố có ký hiệu Mg. Magnesium là nguyên tố phổ biến thứ 8 trong lớp vỏ của Trái Đất. Đây là một kim loại kiềm thổ, vì thế không tồn tại trong tự nhiên ở dạng đơn chất.
Magnesium được tìm thấy trong hơn 60 khoáng chất, nhưng chỉ có magnesit, bruxit, cacnalit, bột tan và olivin là có giá trị thương mại.
2. Tính chất vật lý
- Magie là kim loại tương đối cứng, có màu trắng bạc, chất này rất nhẹ chỉ nặng khoảng 2/3 nhôm nếu cùng thể tích.
- Magnesium bị bao phủ lớp màng oxit khi để ngoài không khí. Mg có khối lượng riêng là 1,737 (g/cm3) có nhiệt độ nóng chảy là 648oC và sôi ở 1095oC.
- Khi ở dạng bột, kim loại magnesium bị đốt nóng bởi nhiệt độ và bắt lửa khi để vào vùng không khí ẩm và cháy tạo ra ngọn lửa màu trắng. Khi ở dạng dày, Mg thường khó bắt lửa, nhưng khi ở dạng lá mỏng thì nó bắt lửa rất nhanh và rất khó dập.
- Mg không tan trong nước nhưng nước đun sôi thì có thể hòa tan Mg.
3. Tính chất hóa học
Magie là chất khử mạnh nhưng yếu hơn natri và mạnh hơn nhôm. Trong hợp chất chúng tồn tại dưới dạng ion M2+.
M → M2+ + 2e
Tác dụng với phi kim:
Trong không khí, Mg bị oxi hóa chậm tạo thành màng oxit mỏng bảo vệ kim loại, khi đốt nóng chúng bị cháy trong oxi.
2 Mg + O2 → 2 MgO
Tác dụng với axit
– Với dung dịch axit clohiđric và axit sulfuric loãng:
Mg + H2SO4 → MgSO4 + H2
– Với dung dịch axít nitric:
+ Khi tác dụng với dung dịch HNO3 loãng, kim loại kiềm thổ khử N+5 thành N-3.
4Mg + 10 HNO3 → 4 Mg(NO3)2 + NH4NO3 + 3H2O
+ Với dung dịch HNO3 đặc hơn, các sản phẩm tạo thành có thể là NO2, NO, …
Tác dụng với nước
– Ở nhiệt độ thường, Mg hầu như không tác dụng với nước. Mg phản ứng chậm với nước nóng.
Mg + 2H2O → Mg(OH)2 + H2
– Magie có thể cháy trong hơi nước thu được MgO và hidro.
Mg + H2O → MgO + H2
4. Cách điều chế Magnesium
Magnesium được điều chế thông qua điện phân magnesium chloride nóng chảy thông qua đó sẽ thu được các nguồn nước mặn, nước suối khoáng hay nước biển.
II. Axit Clohydric HCl
1. HCl là gì?
Tên gọi Axit Clohydric (hay Axit Muriatic) được bắt nguồn từ tiếng Pháp (Acide Chlorhydrique) là một axit vô cơ mạnh tạo ra từ sự hòa tan khí hydro clorua trong nước. Axit HCl cũng được tìm thấy trong dịch vị của con người (đây là 1 trong nguyên nhân gây loét dạ dày khi hệ thống dạ dày hoạt động không hiệu quả).
2. Tính chất hóa học
Tác dụng chất chỉ thị
- Dung dịch HCl làm quì tím hóa đỏ (nhận biết axit)
HCl → H+ + Cl-
Tác dụng với kim loại
- Tác dụng với KL (đứng trước H trong dãy Bêkêtôp) tạo muối (với hóa trị thấp của kim loại) và giải phóng khí hidrô (thể hiện tính oxi hóa)
Cu + HCl → không có phản ứng
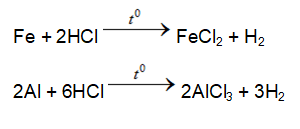
Tác dụng với oxit bazo và bazo:
- Sản phẩm tạo muối và nước
NaOH + HCl → NaCl + H2O
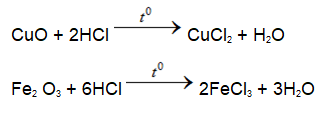
Tác dụng với muối (theo điều kiện phản ứng trao đổi)
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
AgNO3 + HCl → AgCl↓ + HNO3 (dùng để nhận biết gốc clorua)
- Ngoài tính chất đặc trưng là axit, dung dịch axit HCl đặc còn thể hiện vai trò chất khử khi tác dụng chất oxi hóa mạnh như KMnO4, MnO2, K2Cr2O7, MnO2, KClO3 ……
K2Cr2O7 + 14HCl → 3Cl2 + 2KCl + 2CrCl3 + 7H2O
Hỗn hợp 3 thể tích HCl và 1 thể tích HNO3 đặc được gọi là hỗn hợp nước cường toan (cường thủy) có khả năng hòa tan được Au (vàng)
3HCl + HNO3 → 2Cl + NOCl + 2H2O
NOCl → NO + Cl
Au + 3Cl → AuCl3
3. Điều chế axit HCl
Tổng hợp trực tiếp từ khí Clo và Hydro rồi hấp thụ bằng nước sạch cho ra sản phẩm Acid Hydrocloric. Phương trình:
H2 + Cl2 → 2HCl
Môi trường điều chế HCl được diễn ra trong buồng đốt ở nhiệt độ 2000°C. Để không dư khí Clo người ta cho dư khí Hydro để Clo phản ứng hết.
-------------------------------
Ngoài Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









