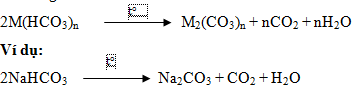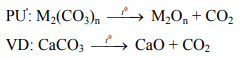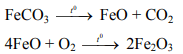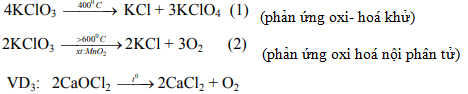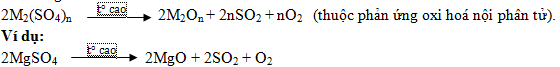Nhiệt phân muối amoni
Chúng tôi xin giới thiệu bài Nhiệt phân muối amoni được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Nhiệt phân muối amoni
Câu hỏi: Nhiệt phân muối amoni
Trả lời:
Nhiệt phân muối amoni (NH+4)
- Tất cả các muối amoni đều kém bền nhiệt và bị phân hủy khi đun nóng.
- Nguyên nhân: do cấu trúc của ion không bền.
- Sản phẩm của phản ứng nhiệt phân phụ thuộc vào bản chất của amoni gốc axit trong muối (có hay không có tính oxi hóa).
I. Khái niệm – Bản chất của phản ứng
- Khái niệm: Phản ứng nhiệt phân là phản ứng phân hủy các hợp chất hoá học dưới tác dụng của nhiệt độ.
- Bản chất: Phân cắt các liên kết kém bền trong phân tử hợp chất vô cơ hay hữu cơ bởi nhiệt độ.
- Lưu ý:
(1) Phản ứng nhiệt phân có thể thuộc phản ứng oxi hóa – khử hoặc không.
(2) Phản ứng điện phân nóng chảy không thuộc phản ứng nhiệt phân vì nó phân hủy dưới tác dụng của dòng điện một chiều.
II. Các trường hợp nhiệt phân
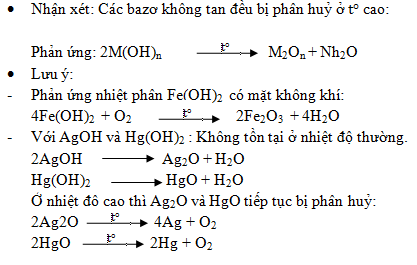
1. Nhiệt phân hidroxit:
2. Nhiệt phân muối
Nhiệt phân muối amoni ()
- Tất cả các muối amoni đều kém bền nhiệt và bị phân hủy khi đun nóng.
- Nguyên nhân: do cấu trúc của ion không bền.
- Sản phẩm của phản ứng nhiệt phân phụ thuộc vào bản chất của amoni gốc axit trong muối (có hay không có tính oxi hóa).
Nhiệt phân muối nitrat (NO3-)
Muối nitrat rất kém bền nhiệt, vì vậy khi nung nóng thì muối nitrat sẽ bị nhiệt phân tạo thành các sản phẩm khác. Sản phẩm tạo thành như thế nào phụ thuộc vào kim loại tạo muối nitrat.
- Nhiệt phân muối nitrat của kim loại đứng trước Mg (Li, K, Ba, Ca, Na)
Muối nitrat → Muối nitrit và O2
2M(NO3)n → 2M(NO2)n + nO2
Ví dụ: 2NaNO3 → 2NaNO2 + O2
- Nhiệt phân muối nitrat của kim loại trung bình (từ Mg đến Cu)
Muối nitrat → Oxit kim loại + NO2 + O2
2M(NO3)n → M2On + 2nNO2 + n/2O2
Ví dụ: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
- Nhiệt phân muối nitrat của kim loại sau Cu
Muối nitrat → kim loại + NO2 + O2
M(NO3)n → M + nNO2 + n/2O2
Ví dụ: 2AgNO3 → 2Ag + 2NO2 + O2
- Một số phản ứng đặc biệt
2Fe(NO3)3 → Fe2O3 + 6NO2 + 3/2O2
NH4NO3 → N2O + 2H2O
NH4NO2 → N2 + 2H2O
Nhiệt phân muối hiđrocacbonat và muối cacbonat:
* Nhiệt phân muối hiđrocacbonat (HCO3-):
* NX: Tất cả các muối hiđrocacbonat đều kém bền nhiệt và bị phân hủy khi đun nóng.
Phản ứng:
* Nhiệt phân muối cacbonat (CO32-) :
* Nhận xét: Các muối cacbonat không tan (trừ muối amoni) đều bị phân hủy bởi nhiệt.
Lưu ý:
- Các phản ứng nhiệt phân muối cacbonat và hiđrocacbonat đều không thuộc phản ứng oxi hoá - khử.
- Phản ứng nhiệt phân muối FeCO3 trong không khí có phản ứng:
Nhiệt phân muối chứa oxi của clo:
* Nhận xét: Tất cả các muối chứa oxi của clo đều kém bền với nhiệt, dễ bị phân hủy khi nung nóng và phản ứng phân hủy đều thuộc phản ứng oxi hoá - khử.
Ví dụ 1:
Ví dụ 2: Phản ứng nhiệt phân muối KCLO3 xảy ra theo 2 hướng.
Nhiệt phân muối sunfat (SO42-):
* Nhận xét:
- Nhìn chung các muối sunfat đều khó bị phân hủy bởi nhiệt so với các muối khác
- Nguyên nhân: Do liên kết trong ion SO42- bền:
- Phản ứng:
+ Các muối sunfat của các kim loại từ: Li đến Ba (Li; K; Ba; Ca; Na) rất khó bị nhiệt phân. Ở nhiệt độ cao nó chuyển từ trạng thái rắn sang trạng thái lỏng).
+ Các muối sunfat của các kim loại khác bị nhiệt phân ở nhiệt độ cao (>1000oC).
Phản ứng:
Nhiệt phân muối sunfit
* Nhận xét: Các muối sunfit đều kém bền nhiệt, dễ bị phân hủy khi nung nóng:
Nhiệt phân muối photphat (PO43-):
*Nhận xét: Hầu như các muối photphat đều rất bền với nhiệt và không bị nhiệt phân ở t0 cao.
III. Bài tập
Bài 1: Đun nóng 127 gam hỗn hợp muối (NH4)2CO3 và NH4HCO3, hỗn hợp phân hủy hết thành khí và hơi nước. Làm nguội sản phẩm đến 27oC thu được 86,1 lít hỗn hợp khí, dưới áp suất 1atm. Tính tỉ lệ số mol hai muối trong hỗn hợp.
Bài giải
Gọi x, y lần lượt là số mol hai muối (NH4)2CO3 và NH4HCO3.
96x + 79y = 127 (1)
Các phương trình phân hủy:
Số mol của hỗn hợp khí:
Từ (2) và (3): 2x +x + y + y = 3x + 2y = 3,5 (4)
Từ (1) và (4) ta có: x = 0,5; y = 1
Vậy tỉ lệ mol hai muối là: x : y = 0,5 : 1 = 1: 2
Bài 2: Khi phân hủy bằng nhiệt độ 1 mol muối A cho 3 chất khí khác nhau, mỗi chất ứng với 1 mol. Biết rằng A bị phân hủy ở nhiệt độ không cao và khối lượng mol phân tử bằng 79. Xác định A.
Bài giải
Một muối bị nhiệt phân không để lại sản phẩm rắn thì phần cation của muối không thể là cation kim loại mà phải cation amoni. Mối lại phân hủy ở nhiệt độ không cao, vậy anion của muối phải là các ion sau: HCO3, CO32-, S2, Cl-
Khi phân hủy cho 3 khí, vậy muối đó phải có oxi trong phân tử. Muối A phải là 1 trong 2 muối (NH4)2CO3 và NH4HCO3.
Do M = 79 nên muối A là NH4HCO3.
Bài 3: Nung 6,58 gam Cu(NO3)2 trong bình kín không chứa không khí, sau một thời gian thu được 4,96 gam chất rắn và hỗn hợp khí X. Hấp thụ hoàn toàn X vào nước để được 300 ml dung dịch Y. Dung dịch Y có pH bằng
Lời giải:
nNO2 = 0,03 ⇒ nHNO3 = 0,03 mol ⇒ CM = 0,1 M ⇒ pH = 1
-------------------------------
Ngoài Nhiệt phân muối amoni đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.