Các ứng dụng của Tinh bột và Xenlulozơ
VnDoc xin giới thiệu bài Các ứng dụng của Tinh bột và Xenlulozơ được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Ứng dụng của Tinh bột và Xenlulozơ
Câu hỏi: Nêu các ứng dụng của Tinh bột và Xenlulozơ?
Trả lời:
- Tinh bột và xenlulozơ được tạo thành trong cây xanh nhờ quá trình quang hợp:
![]()
- Tinh bột là lương thực quan trọng của con người, là nguyên liệu sản xuất đường glucozơ và rượu etylic.
- Xenlulozơ được dùng làm vật liệu xây dựng, sản xuất đồ gỗ, nguyên liệu sản xuất vải sợi, sản xuất giấy…
1. Tinh bột
Khái niệm:
- Tinh bột là chất rắn vô định hình, màu trắng, không tan trong nước. Trong nước nóng từ 65oC trở lên, tinh bột chuyển thành dung dịch keo (hồ tinh bột).
- Tinh bột có nhiều trong các loại ngũ cốc, củ (khoai, sắn), quả (táo, chuối,…)
Cấu trúc phân tử:
+ Tinh bột hỗn hợp của hai polisaccarit: amilozơ và amilopectin. Cả hai đều có công thức phân tử là (C6H10O5)n trong đó (C6H10O5)n là gốc alpha –glucozơ Amilozơ chiếm 20-30% khối lượng tinh bột. Trong phân tử amilozơ các gốc alpha-glucozơ nối với nhau bởi liên kết alpha-1,4-glicozit tạo thành một chuỗi dài không phân nhánh. Phân tử amilozơ không duỗi thẳng mà xoắn lại thành hình lò xo.
+ Tinh bột được tạo thành từ cây xanh nhờ quá trình quang hợp
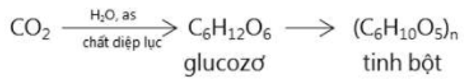
Tính chất hóa học:
+ Phản ứng của polisaccarit (thủy phân):
Thủy phân nhờ xúc tác axit vô cơ: dung dịch thu được sau phản ứng có khả năng tráng bạc
![]()
Thủy phân nhờ enzim
- Quá trình làm bánh mì là quá trình đextrin hóa bằng men và bằng nhiệt. Cơm cháy là hiện tượng đextrin hóa bằng nhiệt
- Ăn bánh mì, cơm cháy dễ tiêu và có vị hơi ngọt vì phân tử tinh bột đã được phân cắt nhỏ thành các đisaccarit và monosaccarit
+ Phản ứng với dung dịch Iot (đặc trưng):
Hồ tinh bột + dung dịch I2→ hợp chất màu xanh tím
Đun nóng thì thấy mất màu, để nguội thì màu xanh tím lại xuất hiện
Ứng dụng:
+ Tinh bột là một trong những chất dinh dưỡng cơ bản của con người và một số động vật.
+ Trong công nghiệp: dùng để sản xuất bánh kẹo, glucozơ và hồ dán.
+ Trong cơ thể người, tinh bột bị thủy phân thành glucozo nhờ các enzim trong nước bọt và ruột non
Điều chế:
Trong tự nhiên, tinh bột được tổng hợp chủ yếu nhờ quá trình quang hợp của cây xanh.
6nCO2 + 5nH2O → (C6H10O5)n + 6nO2 (clorofin, ánh sáng)
2. Xenlulozơ
Khái niệm:
- Xenlulozo là chất rắn hình sợi, màu trắng, không mùi, không vị, không tan trong nước, ngay cả khi đun nóng, không tan trong các dung môi hữu cơ thông thường như ete, benzen...
- Xenlulozo là thành phần chính cấu tạo nên lớp màng tế bào thực vật, là bộ khung của cây cối. Xenlulozo có nhiều trong bông (95% - 98%), đay, gai, tre, nứa (50 - 80%), gỗ (40 - 50%).
Cấu trúc phân tử:
- Công thức phân tử: (C6H10O5)n
- Xenlulozơ là một polime hợp thành từ các mắt xích β – glucozơ bởi các liên kết β – 1,4 – glicozit
- Đặc điểm:
+ Mạch phân tử không nhánh, không xoắn, có độ bền hóa học và cơ học cao
+ Có khối lượng phân tử rất lớn (khoảng 1.000.000 – 2.400.000)
+ Xenlulozơ thuộc loại polime nên không có hai tính chất sau: hòa tan Cu(OH)2 (dù có nhiều nhóm –OH liền kề) và tính khử của anđehit (dù tận cùng phân tử vẫn có nhóm OH –hemiaxetal).
+ Trong mỗi mắt xích C6H10O5 có 3 nhóm – OH tự do, công thức của xenlulozơ có thể được viết là [C6H7O2(OH)3]n
Tính chất hóa học:
- Giống như tinh bột, xenlulozo không có tính khử, thủy phân xenlulozo đến cùng thì thu được glucozo.
- Mỗi mắt xích C6H10O5 có 3 nhóm OH tự do nên xenlulozo có tính chất hóa học của ancol đa chức.
* Phản ứng của polisaccarit (thủy phân)
- Xảy ra khi đun nóng xenlulozơ với dung dịch axit vô cơ
(C6H10O5)n + nH2O → nC6H12O6
- Phản ứng cũng xảy ra nhờ enzim xenlulaza (trong dạ dày trâu, bò…). Cơ thể con người không đồng hóa được xenlulozơ
* Phản ứng của ancol đa chức
- Xenlulozo phản ứng với HNO3/H2SO4 đặc (este hóa):
+ Hiện tượng: Sản phẩm thu được có màu vàng. Khi đốt, cháy nhanh, không khói, không tàn.
+ Giải thích: Xenlulozo phản ứng với (HNO3 + H2SO4) khi đun nóng cho xenlulozo trinitrat.
[C6H7O2(OH)3]n + 3nHNO3H2SO4,to → [C6H7O2(ONO2)3]n + 3nH2O
- Xenlulozo tác dụng với (CH3CO)2O (anhidrit axetic) sinh ra xenlulozo triaxeta.
[C6H7O2(OOCCH3)3]n là chất dẻo dễ kéo thành tơ sợi.
- Xenlulozo không phản ứng với Cu(OH)2 nhưng tan trong dung dịch [Cu(NH3)4](OH)2 (nước svayde) tạo chất lỏng nhớt để tạo tơ đồng - amoniac.
3. Sự khác nhau giữa tinh bột và Xenlulozơ
- Tinh bột và xenlulozo khác nhau về cấu trúc mạch phân tử.
Tinh bột có cấu trúc mạch nhánh, được coi là dự trữ năng lượng lý tưởng do nó không hòa tan trong nước, không khuếch tán ra khỏi tế bào và hầu như không có hiệu ứng thẩm thấu.
Xenlulozo có cấu trúc dạng mạch thẳng, do các phân tử gulozo liên kết với nhau nên có tính bền, dai, phù hợp với chức năng cấu trúc của tế bào thực vật, nó là thành phần cấu tạo chủ yếu của thành tế bào thực vật.
- Nhờ năng lượng ánh sáng và chất diệp lục (clorophin) cây xanh tổng hợp được tinh bột và xenlulozo từ CO2 và H2O.
-------------------------------
Ngoài Các ứng dụng của Tinh bột và Xenlulozơ đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








