Quan sát và viết phương trình: C6H6 + Br2
VnDoc xin giới thiệu bài Quan sát và viết phương trình: C6H6 + Br2 được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Quan sát hiện tượng của phản ứng C6H6 + Br2
Quan sát hiện tượng của phản ứng C6H6 + Br2
Cho benzen vào ống nghiệm chứa dung dịch brom (brom nguyên chất là dung môi không phân cực) trong nước, lắc kĩ benzen không làm mất màu dung dịch nước brom, chất lỏng phân thành hai lớp: Lớp chất lỏng trên là dung dịch brom trong benzen có màu vàng, lớp dưới là nước không màu. Vì benzen không phản ứng với nước brom nhưng hòa tan brom tốt hơn nước.
Phương trình hóa học:
CH≡C – CH2 – CH2 - C≡CH + 4Br2 → Br2HC – CBr2 – (CH2)2 – CBr2 – CHBr2
I. Tính chất vật lý của Benzen
- Benzen C6H6 là chất lỏng, không màu, không tan trong nước, benzen có tính độc.
- Benzen là dung môi hữu cơ hòa tan được nhiều chất như: dầu ăn, cao su, nến, iot...
- C6H6 có khối lượng riêng bằng 0,8786 kg/m3, nóng chảy ở 5,5°C, sôi ở 80,1°C.
Benzen có công thức cấu tạo:
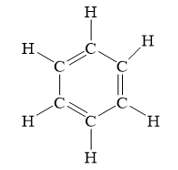
hoặc
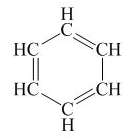
Thường biểu diễn bằng công thức tạo thu gọn:
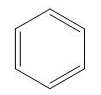
Từ công thức cấu tạo của benzen ta thấy benzen gồm 6 nguyên tử cacbon liên kết với nhau bằng 3 liên kết đôi xen kẽ 3 liên kết đơn tạo thành mạch vòng hình lục giác đều.
II. Tính chất hóa học của Benzen
Benzen có những phản ứng hóa học đặc trưng như phản ứng cháy, phản ứng thế, phản ứng cộng. C6H6 vừa có phản ứng thế vừa có phản ứng cộng nhưng phản ứng cộng xảy ra khó hơn so với C2H4 và C2H2.
1. Phản ứng cháy
Tượng tự các hidrocacbon khác, benzen cháy trong không khí tạo ra khí cacbonic (CO2) và hơi nước (H2O), ngoài ra ngọn lửa có nhiều khói đen là do sản phẩm cháy còn có muội than. Nguyên nhân là do phân tử benzen có phân tử khối lớn, nên khó cháy hoàn toàn thành khí CO2 và hơi nước.
Phương trình cháy:
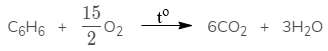
2. Phản ứng thế
Với dung dịch brom
Benzen có phản ứng với dung dịch brom không?
- Hiện tượng: Benzen không phản ứng với dung dịch brom, chất lỏng trong ống nghiệm chia làm hai lớp, benzen nặng hơn nên chìm xuống dưới còn dung dịch brom nổi lên trên.
- Còn khi đun nóng benzen với brom lỏng nguyên chất, có mặt bột sắt thì người ta thấy màu đỏ nâu của brom mất đi và có khí hidro bromua thoát ra. Như vậy benzen đã tác dụng với brom.
- Kết luận: Benzen không tác dụng được với dung dịch nước brom (gồm brom và nước) như axetilen hay etilen mà benzen chỉ tác dụng được với brom nguyên chất có mặt bột sắt và đun nóng.
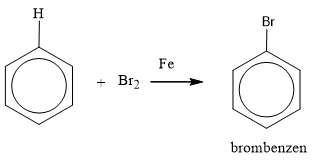
- Viết gọn:
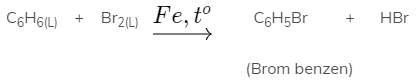
Nguyên tử H của benzen đã được thay thế bởi nguyên tử Br. Phản ứng thuộc loại phản ứng thế.
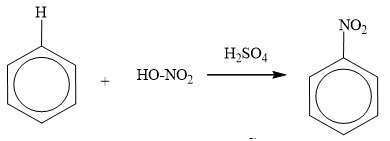
b) Phản ứng nitro hóa
Benzen tác dụng với hỗn hợp HNO3 đặc và H2SO4 đậm đặc tạo thành nitrobenzen:
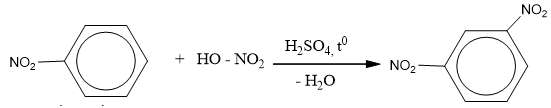
Nitro benzen tác dụng với hỗn hợp axit HNO3 bốc khói và H2SO4 đậm đặc đồng thời đun nóng thì tạo thành m-đinitrobenzen.
c) Quy tắc thế ở vòng benzen
Khi vòng benzen đã có sẵn nhóm ankyl (hay các nhóm –OH, -NH2, -OCH3,...
Phản ứng thế vào vòng sẽ dễ dàng hơn và ưu tiên xảy ra ở vị trí nhóm ortho và para. Ngược lại, nếu ở vòng benzen đã có sẵn nhóm –NO2 (hoặc các nhóm –COOH, -SO3H, ...) phản ứng thế vào vòng sẽ khó hơn và ưu tiên xảy ra ở vị trí meta.
d) Cơ chế phản ứng thế ở vòng benzen
Phân tử halogen hoặc phân tử axit nitric không trực tiếp tấn công. Các tiểu phân mang điện tích dương tạo thành do tác dụng của chúng với xúc tác mới là tác nhân tấn công trực tiếp vào vòng benzen. Thí dụ:
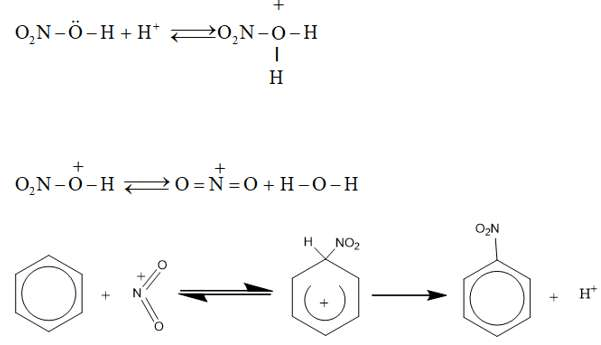
3. Phản ứng cộng
- Benzen không tác dụng được với brom trong dung dịch, chứng tỏ benzen khó tham gia phản ứng cộng hơn etilen và axetilen. Tuy nhiên, trong điều kiện thích hợp, benzen có phản ứng cộng với một số chất như H2, Cl2,…
![]()
Kết luận: Do phân tử có cấu tạo đặc biệt nên benzen vừa có phản ứng thế vừa có phản ứng cộng, tuy nhiên benzen khó tham gia phản ứng cộng hơn axetilen và etilen.
III. Điều chế
C6H6 được điều chế bằng cách trùng hợp C2H2 trong điều kiện thích hợp hoặc cho axit benzoic tác dụng với NaOH.
3C2H2 (t°, Ni) → C6H6
C6H5COOH + NaOH → C6H6 + Na2CO3
IV. Ứng dụng
- Trong công nghiệp hóa hữu cơ, benzen là nguyên liệu quan trọng nhất để sản xuất nhiều loại hợp chất như chất dẻo, cao su, phẩm nhuộm, dược phẩm, thuốc trừ sâu, thuốc nổ TNT...
- Ngoài ra benzen còn được dùng làm dung môi để hòa tan nhiều chất hữu cơ trong công nghiệp hay trong phòng thí nghiệm.
-------------------------------
Ngoài Quan sát và viết phương trình: C6H6 + Br2 đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








