Nêu cách điều chế Axit Axetic trong công nghiệp?
VnDoc xin giới thiệu bài Nêu cách điều chế Axit Axetic trong công nghiệp? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cách điều chế Axit Axetic trong công nghiệp
Câu hỏi: Nêu cách điều chế Axit Axetic trong công nghiệp?
Trả lời:
- Trong công nghiệp, axit axetic được điều chế từ butan C4H10:
![]()
- Để sản xuất giấm ăn, thường dùng phương pháp lên men dung dịch rượu etylic loãng.
![]()
Câu hỏi tham khảo: Trong công nghiệp, phương pháp điều chế axit axetic hiện đại nhất là
- lên men giấm
- oxi hóa anđehit axetic
- đi từ metanol
- oxi hóa butan
Đáp án: C. đi từ metanol
Giải thích chi tiết
Trong công nghiệp, axit axetic có thể được điều chế theo phương án A, B và C. Tuy nhiên phương pháp đi từ metanol cho giá thành thấp nhất do CH4 có sẵn trong khí thiên nhiên và khí dầu mỏ:
I. Tính chất vật lí
Axit axetic là chất lỏng, không màu, vị chua, tan vô hạn trong nước.
Dung dịch axit axetic nồng độ từ 2 – 5 % dùng làm giấm ăn.
II. Cấu tạo phân tử
Axit axetic có công thức cấu tạo:
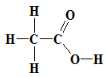
viết gọn CH3COOH.
Trong phân tử axit axetic có nhóm –COOH làm cho phân tử có tính axit.
III. Tính chất hóa học nổi bật của axit axetic CH3COOH
- Axit axetic là chất lỏng không màu, có vị chua và tan vô hạn trong nước.
- Dung dịch axit axetic nồng độ từ 2 - 5% sẽ được dùng làm giấm ăn.
- Với công thức CH3COOH, gồm 1 nhóm -OH liên kết với nhóm C=O tạo thành nhóm -COOH và chính nhóm -COOH làm cho phân tử có tính axit.
- Axit axetic là một axit yếu, yếu hơn các axit HCl, H2SO4, HNO3, H2SO3 nhưng mạnh hơn axit cacbonic H2CO3. Axit axetic cũng có đầy đủ tính chất của một axit.
Tính chất hóa học của axit axetic như:
Tính axit yếu
- Dung dịch axit axetic làm đổi màu quỳ tím thành đỏ.
- Axit axetic tác dụng với oxit bazo, bazo tạo thành muối và nước
CH3COOH + NaOH → CH3COONa + H2O
Ví dụ cho axit axetic tác dụng với natri axetat (CH3COONa), ta có phương trình:
CH3COOH + CaO → (CH3COO)Ca + H2O
- Axit axetic tác dụng với kim loại trước H giải phóng H2
2CH3COOH + 2Na → 2CH3COONa +H2
- Axit axetic tác dụng với axit yếu hơn
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2 +H2O
Axit axetic tác dụng với rượu tạo ra este và nước (xúc tác là H2SO4 đặc nóng)
CH3COOH + HO-C2H5 → CH3COOC2H5 + H2O
Phản ứng cháy
Axit axetic cháy trong oxy tạo sản phẩm gồm CO2 và H2O:
CH2COOH + 2O2 (nhiệt độ) → 2CO2 + 2H2O
IV. Các phương pháp điều chế axit axetic
- Trong công nghiệp, đi từ Butan C4H10
2CH10 + 3O2 (xúc tác, to) → 4CH3COOH + 2H2O
- Để sản xuất giấm ăn, người ta thường dùng phương pháp lên men dung dịch rượu etylic loãng
CH3CH2OH + O2 → CH3COOH + 2H2O
Chú ý: Những hợp chất hữu cơ phân tử có chứa nhóm -COOH, có công thức thức CnH2n +1 COOH được gọi là axit cacboxylic no đơn chức và cũng có tính chất tương tự axit axetic.
V. Bài tập trắc nghiệm
Câu 1: Giấm ăn là dung dịch axit axetic có nồng độ
A. trên 10 %.
B. dưới 2 %.
C. từ 2% - 5%.
D. từ 5% - 10%.
Đáp án: C
Câu 2: Phản ứng giữa axit axetic với dung dịch bazơ thuộc loại
A. phản ứng oxi hóa - khử.
B. phản ứng hóa hợp.
C. phản ứng phân hủy.
D. phản ứng trung hòa.
Đáp án: D
Câu 3: Dãy chất tác dụng với axit axetic là
A. ZnO; Cu(OH)2; Cu; CuSO4 ; C2H5OH.
B. CuO; Ba(OH)2; Zn ; Na2CO3 ; C2H5OH.
C. Ag; Cu(OH)2; ZnO ; H2SO4; C2H5OH.
D. H2SO4; Cu(OH)2; C2H5OH; C6H6; CaCO3.
Đáp án: B
Câu 4: Trong công nghiệp một lượng lớn axit axetic được điều chế bằng cách
A. nhiệt phân metan sau đó làm lạnh nhanh.
B. lên men dung dịch rượu etylic.
C. oxi hóa etan có xúc tác và nhiệt độ thích hợp.
D. oxi hóa butan có xúc tác và nhiệt độ thích hợp.
Đáp án: D
Câu 5: Để phân biệt dung dịch axit axetic và rượu etylic ta dùng kim loại nào sau đây?
A. Na.
B. Zn.
C. K.
D. Cu.
Đáp án: B
-------------------------------
Ngoài Nêu cách điều chế Axit Axetic trong công nghiệp? đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








