Hoàn thành phương trình phản ứng sau C2H2 + H2O
Hoàn thành phương trình phản ứng sau C2H2 + H2O được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Hoàn thành phương trình phản ứng sau
Câu hỏi: Hoàn thành phương trình phản ứng sau:
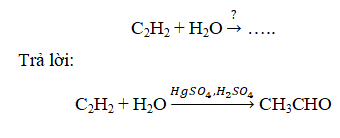
- C2H2 là Hidrocacbon Không no
- CH3CHO là andehit no đơn chức
+ Điều kiện phản ứng: HgSO4, H2SO4
+ Phản ứng Cộng H2O
Giải thích: C2H2 là Ankin, Ankin tham gia phản ứng cộng nước theo tỉ lệ mol 1:1
→ Tạo thành Anđehit
I. Phản ứng cộng HX của Hidrocacbon không no
1. Phản ứng cộng HX vào anken
- Phương trình phản ứng tổng quát cộng HX vào anken:
CnH2n + HX → CnH2n + 1X
- Chú ý:
+ Phản ứng cộng HX vào anken bất đối tạo ra hỗn hợp 2 sản phẩm.
+ Sản phẩm chính của phản ứng cộng được xác định theo quy tắc cộng Maccopnhicop: H cộng vào C ở liên kết đôi có nhiều H hơn còn X vào C ở liên kết đôi có ít H hơn.
+ Nếu thực hiện phản ứng cộng HBr vào anken có xúc tác peoxit thì sản phẩm chính lại ngược quy tắc Maccopnhicop.
2. Phản ứng cộng HX vào ankin
- Cộng H 2 O: khác với các phản ứng cộng khác, phản ứng cộng nước vào ankin chỉ xảy ra theo tỉ lệ 1:1 vì sản phẩm tạo thành ở giai đoạn này là ancol không bền ngay lập tức chuyển hoá thành sản phẩm khác bền hơn không thể tham gia cộng nước được nữa.
+ C2H2 → anđehit
CHΞCH + H2O → CH3 - CHO (H2SO4, HgSO4, 80oC)
+ Ankin khác → xeton
CHΞC-CH3 + H2O → CH3-CO-CH3 (H+)
- Cộng axit:
CHΞCH + HCl → CH2=CHCl (vinyl clorua) (Hg2Cl2 ở 150 đến 200oC)
CHΞCH + HCN → CH2=CH-CN (nitrin acrylic)
CHΞCH + CH3COOH → CH3COOCH=CH2 (vinylaxetat)
CHΞCH + C2H5OH → CH2=CH-O-CH3 (etylvinylete)
3. Phản ứng cộng HX vào ankađien
- Vi chứa 2 liên kết đôi C=C nên ankađien có thể tham gia vào phản ứng cộng theo tỉ lệ mol 1:1 hoặc 1:2. Phức tạp nhất là trường hợp cộng vào ankađien liên hợp.
- Phản ứng cộng của ankađien liên hợp với HX và cũng tuân theo các quy tắc như trường hợp cộng vào anken. Vì có thể xảy ra theo tỉ lệ 1:1 hoặc 1:2 và theo tỉ lệ 1:1 cũng có 2 kiểu cộng 1,2 và 1,4 nên khi tác dụng với tác nhân bất đối là HX phản ứng tạo ra hỗn hợp gồm nhiều sản phẩm.
4. Phản ứng trùng hợp
- Là quá trình cộng hợp liên tiếp nhiều phân tử nhỏ giống nhau hoặc tương tự nhau tạo thành phân tử lớn (hợp chất cao phân tử).
- Sơ đồ phản ứng trùng hợp:
nA → (B)n (to, xt, p)
- Tên B = polime + tên monome (nếu tên monome gồm nhiều từ thì đặt trong ngoặc).
- Một số phản ứng trùng hợp thường gặp với hiđrocacbon:
nCH2=CH2 → (-CH 2–CH2-)n (Polietilen hay PE)
nCH2=CH–CH3 → (-CH2–CH(CH3)-)n (Polipropilen hay PP)
2CHΞCH → CHΞC-CH=CH2 (vinyl axetilen) (NH4Cl, Cu2Cl2, to)
3CHΞCH → C6H6 (C, 600oC)
nCHΞCH → (-CH=CH-)n (xt, to, p) (nhựa cupren)
n-C6H5-CH=CH2 → (-CH2-CH(C6H5)-)n (to, xt, p) (Polstiren - PS)
nCH2=CH-CH=CH2 → (-CH2-CH=CH-CH2-)n (Na, to) (Cao su buna)
nCH2=C(CH3)-CH=CH2 → (-CH2-C(CH3)=CH-CH2-)n (xt, to, p) (Cao su isopren)
II. Axit sunfuric là gì?
1. Khái niệm axit sunfuric
- Axit sunfuric là một axit có công thức là H2SO4. Nó tồn tại dưới dạng chất lỏng không màu, không mùi, không bay hơi. H2SO4 nặng hơn nước và có khả năng hòa tan vào nước ở bất kỳ tỷ lệ nào. Đây là một loại axit được đánh giá cực mạnh và được dùng chủ yếu trong các ngành công nghiệp, hay làm chất xúc tác cho các phản ứng hóa học.
- Bạn có thể dễ dàng tìm được loại axit này ở bất kỳ nơi đâu. Mà dễ thấy và dễ nhận biết nhất là trong nước mưa. Nếu bạn dính nước mưa và cảm thấy rát, khó chịu thì đó là do tác dụng của axit sunfuric.
- Hiện nay, chưa có một nhà khoa học nào tìm được mẫu H2SO4 tinh khiết trên Trái Đất. Mà nó chỉ tồn tại dưới dạng chất lỏng có chứa nhiều hỗn hợp các chất khác nhau. Và vì vậy mà H2SO4 tinh khiết chỉ được điều chế từ các chất hóa học phản ứng với nhau tạo thành.
2. Các tính chất của axit sunfuric
- Axit sunfuric có hai loại, axit sunfuric loãng và axit sunfuric đặc. Mỗi loại sẽ có những tính chất vật lý và tính chất hóa học khác nhau.
Tính chất vật lý của H2SO4
- H2SO4 đặc hay loãng đều có điểm chung tồn tại dưới dạng chất lỏng, không màu, không mùi và không vị.
- H2SO4 loãng có đặc tính là khó bay hơi và tan vô hạn trong nước. Còn H2SO4 đặc nổi bật với khả năng hút nước rất mạnh và tỏa nhiều nhiệt. Vì vậy bạn chú ý không nên cho nước vào axit mà chỉ được phép cho axit vào nước. Để đánh trường hợp bị bỏng xảy ra khi nước tác dụng với axit. Và H2SO4 còn có thể pha loãng ra để trở thành H2SO4 loãng. Nhưng bạn nhớ thực hiện đúng quy trình ở trên để không gặp những tình trạng nguy hiểm.
Tính chất hóa học của H2SO4
*Đối với axit sunfuric loãng
- Đây là một loại axit có đặc tính cực kỳ mạnh nên có đầy đủ những tính chất hóa học của một loại axit thông thường. Điển hình như:
+ Làm thay đổi màu quỳ tím sang đỏ
+ Phản ứng với các kim loại, bazo, oxit bazo, muối để tạo ra những chất hóa học như mong muốn.
*Đối với axit sunfuric đặc
- Axit sunfuric đặc có những tính chất hóa tương tự như axit sunfuric lỏng. Ngoài ra, còn một số đặc trưng riêng của loại axit này đó là:
+ Khi tác dụng với kim loại, thêm đồng (Cu) vào thì dung dịch sẽ tạo ra màu xanh
+ H2SO4 đặc còn có tính chất háo nước rất mạnh. Ví dụ như đưa H2SO4 đổ vào chén đường trắng thì chỉ sau vài phút nước sẽ chuyển thành màu đen và phun trào
3. Ứng dụng phổ biến của Axit sunfuric H2SO4
H2SO4 là một chất hóa học quan trọng bởi nó ứng dụng rất nhiều trong các ngành công nghiệp.
*Trong công nghiệp sản xuất:
Axit sunfuric H2SO4 có mặt trong hầu hết các ngành công nghiệp như: luyện kim, phẩm nhuộm, chất tẩy rửa, giấy, sợi. Theo ước tính hằng năm có hơn 160 triệu tấn H2SO4 được sản xuất ra để phục vụ các ngành công nghiệp này. Một con số không hề nhỏ!
*Sản xuất phân bón:
Một ứng dụng chủ yếu của H2SO4 là dùng làm phân bón. Đây là một trong những thành phần quan trọng nhất dùng sản xuất các loại phân bón. Các loại phân bón được sản xuất từ H2SO4 gồm: Phosphate, Canxi dihydrogen, Amoni Phosphate, Amoni Sunfat…
*Xử lý nước thải
H2SO4 là chất hóa học cốt lõi dùng để điều chế Nhôm hidroxit - một thành phần không thể thiếu khi xử lý nước trong các nhà máy. Nhôm hidroxit sẽ có vai trò lọc các tạp, khử mùi cho nước, cân bằng độ pH trong nước. Đặc biệt quan trọng là dùng để loại bỏ các kim loại nặng trong nước như Mg, Ca, giúp phòng tránh nguy cơ nước bị nhiễm phèn.
4. Một số lưu ý khi sử dụng Axit sunfuric
Theo tính chất hóa học của H2SO4 thì nó là một axit cực kỳ mạnh. Vì vậy khi sử dụng chất hóa học này mọi người cần đặc biệt chú ý những điều sau:
+ Không bao giờ được tiếp xúc trực tiếp với H2SO4 nguyên chất hay được pha loãng. Bởi nó sẽ gây bỏng da rất nặng, có thể bị mù nếu bắn vào mắt…Còn những vật dụng như vải hay giấy sẽ bốc cháy nếu tiếp xúc với H2SO4 nên bạn cần bảo quản nó ở nơi thật cẩn thận.
+ Khi pha H2SO4 chỉ được pha theo chiều axit đổ vào nước và không có chiều ngược lại. Phải đổ từ từ H2SO4 vào nước nếu không sẽ bị phun trào và bắn axit cực kỳ nguy hiểm.
+ Phải lựa chọn mua H2SO4 tại những địa điểm uy tín, chất lượng để đảm chất an toàn, chất lượng khi sử dụng.
-------------------------------
Ngoài Hoàn thành phương trình phản ứng sau C2H2 + H2O đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.









