Cách điều chế muối không tan
Cách điều chế muối không tan được VnDoc sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Cách điều chế muối không tan
Câu hỏi: Cách điều chế muối không tan?
Trả lời:
- Muối không tan có nhiều dạng muối
+ Muối amoni là muối của NH3 với axit.
+ Cách điều chế:
- NH3 + axit.
- Dùng phản ứng trao đổi ion.
+ Các gốc muối không tan của kim loại nặng: AgCl, CaCO3, BaCO3, …
Phương trình ion rút gọn:
Ag+ + Cl- → AgCl
Ba2+ + Co32- → BaCO3
Ca2+ + CO32- → CaCO3
1. Muối không hòa tan là gì?
Muối không tan là hợp chất muối không tan trong nước ở nhiệt độ thường. Chúng không hòa tan trong nước vì các phân tử nước không thể thu hút các ion trong hợp chất muối. Do đó, giữa các phân tử nước và các hợp chất muối không tan không có tương tác giữa các phân tử.
Hơn nữa, các muối không hòa tan là các hợp chất không phân cực. Không giống như các muối hòa tan, sự trộn lẫn các muối không hòa tan với nước không làm cho dung dịch dẫn điện vì muối không phân ly thành các ion. Một ví dụ điển hình về muối không tan là bạc clorua (AgCl).
Còn muối không tan trong nước (kết tủa) muốn tan trong axit thì phải phản ứng với dung dịch axit tạo chất tan.
*Cách nhớ các muối tan:
+ Các muối kim loại kiềm, amoni đều tan trong nước.
+ Tất cả các muối nitrat đều tan.
+ Muối cacbonat đa số không tan trừ muối kim loại kiềm.
+ Muối sunfat đều tan trừ BaSO4; .
+ Muối Cl đều tan trừ AgCl và PbCl2.
+ Muối photphat không tan trừ muối kim loại kiềm và amoni,
2. Bảng tính tan là gì?
Bảng tính tan là bảng tổng hợp tính tan hay không tan của các chất trong nước, tuy nhiên, tính tan của Axit – Bazơ và Muối rất đa dạng và phụ thuộc nhiều yếu tố có chất có thể tan hoàn toàn trong nước, chất khác ít tan hoặc thậm chí là không tan trong nước.
3. Định nghĩa về độ hòa tan
Độ hòa tan hay độ tan cho thấy khả năng hòa tan của một chất ( rắn, lỏng, khí) trong dung môi để tạo thành một chất bão hòa trong nhiệt độ nước.
Bảng tính tan môn Hóa học cần thiết với các bạn học sinh
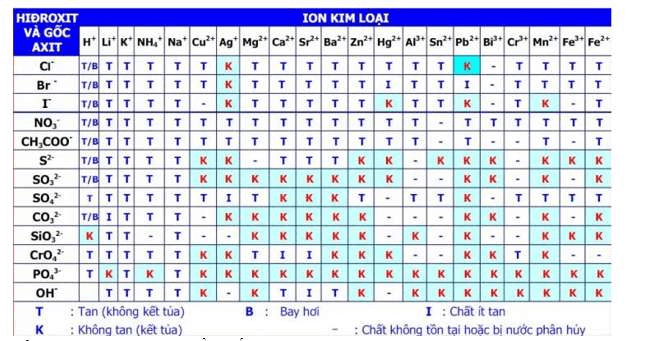
+ Chú thích:
T: chất dễ tan
I: chất ít tan
K: chất không tan (ô màu xanh)
B: chất bay hơi
–: chất không tồn tại hoặc bị nước phân huỷ
*Cách đọc bảng tính tan
Bảng tính tan gồm các hàng và các cột. Cột là các cation kim loại, còn hàng là các anion gốc axit (hay OH-). Với một chất cụ thể, ta sẽ xác định ion dương và ion âm, gióng theo hàng và cột tương ứng ta sẽ biết được trạng thái của chất đó tại một ô.
Với đặc trưng ở trên có thể xác định được chất tan hay không tan dựa vào thông tin sau:
+ Nếu lấy trên 10g chất đó có thể hòa tan được trong 100g nước hòa tan thì chất này được gọi là chất tan hay chất dễ tan
+ Nếu chỉ dưới 1g chất đó được hòa tan trong 100g nước thì đó là chất ít tan
+ Nếu chỉ có 0,01 chất đó được hòa tan trong 100g nước thì chúng được gọi là chất không tan
4. Ý nghĩa của bảng tính tan hóa học
Để giải những bài toán hóa học về tính tan, kết tủa hay sự bay hơi trong phòng thí nghiệm thì học sinh cần phải có được phiếu tính tan. Do vậy, những kiến thức trong bảng tính tan đầy đủ thì bạn cần phải nắm rõ.
Bảng tính tan hóa học bao gồm rất nhiều kiến thức và cả những quy tắc do vậy mà việc ghi nhớ kiến thức này không hề dễ dàng. Theo đó các bạn hãy tra cứu chi tiết thông tin trong đó để chủ động giải và xử lý những bài toán về hóa học hay khi làm các thí nghiệm.
5. Các yếu tố ảnh hưởng đến độ tan của một chất
Tính hóa tan của một chất có tác động của nhiều yếu tố, do vậy các bạn cần phải nắm được thông tin sau đây:
Nhiệt độ
+ Đối với chất khí, độ tan của nó sẽ tỷ lệ nghịch với nhiệt độ khi trong dung môi. Người ta thường đun nóng chất khí để loại bỏ những chất như CO2 và O2 ra khỏi dung môi mà không làm biến đổi cũng như làm phân hủy chất. Đồng thời còn giúp được dược chất ổn định.
+ Chất rắn thu nhiệt thì khi nhiệt độ càng cao khiến cho độ hòa tan càng lớn. Còn với chất rắn tỏa nhiệt khi hòa tan thì ngược lại nhiệt độ càng giảm, độ tan sẽ càng tăng.
Áp suất (đối với chất khí)
Như các bạn học hóa đã biệt, trong định luật Henry, nếu các chất khí có độ tan nhỏ và áp suất không quá cao thì khi tăng áp suất trên bề mặt chất lỏng không đổi thì lượng chất khí hòa tan trong một thể tích chất lỏng xác định cũng sẽ tăng. Và ngược lại.
Độ phân cực của chất tan và dung môi
+ Các chất phân cực cũng thường dễ tan hơn trong môi trường dung môi phân cực cụ thể như kiềm, nước, dung dịch muối hay axit vô cơ,…
+ Những chất ít phân cực cũng sẽ dễ tan môi trường dung môi hữu cơ kém phân cực bao gồm chloroform, benzene, toluene, dicloromethan,…
Dạng thù hình
Thường loại chất rắn dạng vô định hình sẽ có độ tan lớn hơn so với chất rắn dạng tinh thể trong cùng một môi trường dung môi. Đó là bởi khi chất rắn ở dạng kết tinh thì sẽ có cấu trúc mạng lưới tinh thể tương đối bền vững. Bởi vậy mà nó cần nhiều năng lượng để có thể phá vỡ cấu trúc hơn. Ngược lại thì chất rắn dưới dạng vô định hình sẽ không ổn định như dạng tinh thể, chúng có xu hướng chuyển sang dạng tinh thể.
Hiện tượng hydrat hóa
Trong quá trình kết tinh, chất rắn thường có thể được tồn tại dưới dạng ngậm nước hoặc dạng khan. Đối với dạng ngậm nước, chất rắn ở dạng khan sẽ có tính tan lớn hơn.
Hiện tượng đa hình
Với môi trường kết tinh khác nhau sẽ tạo điều kiện để chất rắn tồn tại dưới các dạng tinh thể khác nhau bao gồm Hydrat, đồng kết tinh, .. cùng với những tính chất vật lý và độ tan trong dung môi không giống nhau. Thường với những tinh thể kém bền vững thì sẽ đòi hỏi ít năng lượng trong phá vỡ cấu trúc do vậy mà dễ tan hơn.
Độ pH của dung dịch
+ Khi kiềm hóa dung môi, axit yếu sẽ có độ tan tăng lên
+ Nếu axit hóa dung môi, độ tan của các chất kiềm yếu sẽ tăng lên
+ Đối với những chất lưỡng tính, độ tan của các chất này giảm dần khi mà độ pH càng gần điểm đẳng điện và ngược lại.
Chất điện ly
Độ tan của các chất tan có thể bị giảm trong chất điện ly trong dung dịch do vậy bạn cần phải lưu ý pha loãng chất điện ly trước khi hòa vào dung dịch.
Các ion cùng tên
Trường hợp nồng độ của các ion cùng tên tăng lên, có thể làm cân bằng điện ly của chất tan thì sẽ làm chuyển dịch về hướng phân tử ít tan và làm giảm đi độ tan của chất. Bởi vậy mà trong quá trình hóa tan, bạn cần phải tiến hành với những chất ít tan trước, sau đó mới đến những chất dễ tan.
Hỗn hợp dung môi
Nếu như bạn kết hợp các hỗn hợp dung môi đồng tan cùng với nước cụ thể như glycerin-ethanol-nước thì sẽ làm tăng độ tan của những chất khó tan.
-------------------------------
Ngoài Cách điều chế muối không tan đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








