Phản ứng C2H5OH + CH3COOH xảy ra như thế nào?
Phản ứng C2H5OH + CH3COOH xảy ra như thế nào? được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Phản ứng C2H5OH + CH3COOH xảy ra như thế nào?
Câu hỏi: Phản ứng C2H5OH + CH3COOH xảy ra như thế nào?
C2H5OH + CH3COOH ⇌ H2O + CH3OOC2 5
- Điều kiện: Nhiệt độ: 140°C Xúc tác: H2SO4 đặc
- Cách thực hiện: Cho rượu etylic, axit axetic vào ống nghiệm A. Thêm tiếp một ít axit sunfuric đặc vào làm xúc tác. Đun sôi hỗn hợp trong ống nghiệm A một thời gian, sau đó ngừng đun. Thêm một ít nước vào chất lỏng ngưng tụ trong ống nghiệm B, lắc nhẹ rồi quan sát.
- Hiện tượng: Trong ống nghiệm B có chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
- Kết luận: Axit axetic tác dụng với rượu etylic tạo ra etyl axetat.
I. Axit axetic (CH3COOH)
1. CH3COOH là gì?
CH3COOH là chất gì, đây là công thức hóa học của axit axetic hay Acid Acetic.
Axit Axetic là một hợp chất hữu cơ có tính axit mạnh, được sản xuất từ rất lâu đời và được ứng dụng cao trong các ngành sản xuất công nghiệp, sản xuất thực phẩm hay lĩnh vực y học...
Ngoài ra, nó còn có những tên gọi khác nhau như: etanoic, Hydro axetat (HAc), Ethylic acid, Axit metanecarboxylic, dấm, acetic acid, Acid ethanoic…
2. Cấu tạo phân tử của CH3COOH axit axetic
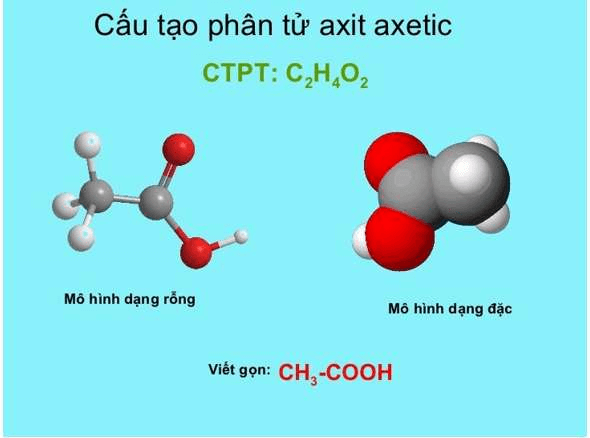
Cấu tạo phân tử của CH3COOH axit axetic
3. Những tính chất lý hóa đặc trưng của axit axetic CH3COOH
3.1 Những tính chất vật lý nổi bật
- Axit này là một chất lỏng không màu, có vị chua và tan vô hạn ở trong nước.
- Là một chất dễ cháy và ở nhiệt độ ấm hơn 39°C.
- Là hợp chất hữu cơ dễ bay hơi của các chất ô nhiễm.
- Trọng lượng riêng: 1,049 (25°C)
- Điểm nóng chảy: 16,7°C
- Điểm sôi: 118°C
- Hơi áp suất: 1,5 kPa (20°C)
3.2 Những tính chất hóa học đặc trưng của CH3 OOH
CH3COOH là một axit nên nó có những tính chất đặc trưng của một axit. Cụ thể như sau:
+ Làm quỳ tím đổi màu thành hóa đỏ.
+ Tác dụng với bazơ tạo thành muối và nước: CH3COOH + NaOH → H2O + CH3COONa
+ Tác dụng với oxit bazơ tạo thành muối và nước: CH3COOH +CaO → H2O + (CH3COO)2Ca
+ Tác dụng với kim loại đứng trước H trong bảng tuần hoàn nguyên tố hóa học để giải phóng H2: 2CH3COOH + Na→ H2 + 2CH3COONa
+ Tác dụng với muối của Axit yếu hơn: CH3COOH +CaCO3 → H2O + (CH3COO)2Ca + CO2
+ Tác dụng với rượu tạo ra este và nước với chất xúc tác là H2SO4 và nhiệt độ: CH3COOH + HO–C2H5 → H2O + CH3COOC2H5 + H2O
4. Điều chế, sản xuất CH3COOH
Axit Axetic CH3COOH được điều bằng các phương pháp quen thuộc dưới đây:
4.1 Điều chế bằng cách cacbonyl hóa metanol
Ta cho metanol và cacbon monoxit phản ứng với nhau sẽ tạo ra axit axetic:
CH3OH + CO → CH3COOH
4.2 Oxy hóa axetaldehyt để điều chế CH 3 COOH
Axetaldehyt có thể bị oxy hóa bởi oxy trong không khí, để tạo ra axit axetic dưới tác dụng của những điều kiện xúc tác (sự có mặt các ion kim loại: mangan, coban, và crôm, peroxit).
2CH3CHO + O2 → 2 =CH3COOH
4.3 Oxy hóa etylen
Quá trình này sử dụng chất xúc tác là kim loại paladi với sự hỗ trợ của axit heteropoly như axit tungstosilicic.
Đây là một phương pháp có thể cạnh tranh với phương pháp cacbonyl hóa metanol đối với các nhà máy nhỏ hơn (100–250 ngàn tấn/năm), tùy thuộc vào giá của etylen.
4.4 Lên men oxy hóa của CH3COOH
Khi cung cấp đủ oxy, các vi khuẩn này có thể tạo ra giấm từ các thực phẩm sinh cồn khác nhau như rượu táo, rượu vang hay các loại ngũ cốc (gạo, mạch nha hoặc khoai tây) lên men.
C2H5OH + O2 → CH3COOH + H2O
4.5 Lên men kỵ khí để sản xuất axit axetic
Các loài vi khuẩn kỵ khí bao gồm cả thuộc chi Clostridium, có thể chuyển đổi đường thành axit axetic một cách trực tiếp mà không cần phải qua bước trung gian: C6H12O6 → 3CH3COOH
5. Những ứng dụng quan trọng của CH3COOH
5.1 Ứng dụng của axit axetic trong công nghiệp
+ Khoảng 40% - 45% sản lượng axit acetic trên thế giới được dùng để giúp sản xuất monome vinyl axetate - đây là chất kết dính và sơn.
+ CH3COOH được dùng để làm dung môi hoặc dùng để tạo độ chua nhẹ.
+ Axit axetic băng là một dung môi protic phân cực tốt, nên chúng được dùng làm dung môi.
+ CH3COOH 5-7% là dấm ăn, cái tên rất quen thuộc hiện nay và được dùng trong công nghệ thực phẩm để chế biến đồ hộp, rau, quả hay các loại gia vị.
+ Sử dụng trong hóa phân tích để ước tính các chất có tính kiềm yếu như các amit hữu cơ hoặc dùng trong các phòng thí nghiệm lâm sàng.
+ Được dùng làm chất tẩy cặn vôi từ vòi nước và ấm đun nước.
+ Dùng trong ngành dệt nhuộm, cao su và hóa chất xi mạ.
+ Axit này chủ yếu được sử dụng trong sản xuất của cellulose acetate trong lĩnh vực phim ảnh và polyvinyl acetate gỗ keo.
5.2 Ứng dụng của CH 3 COOH trong ngành y học hiện đại
- Nhờ đặc tính kháng khuẩn nên nó được sử dụng như một chất khử trùng (với nồng độ 1% pha loãng), giúp ngăn ngừa nhiễm trùng và tiêu diệt vi khuẩn.
- Được chế phẩm thành thuốc để chống bệnh tiểu đường.
5.3 Vai trò với sức khỏe con người
- Có tác dụng ức chế hoạt động thủy phân đường đôi thành đường đơn, để giảm chứng tăng đường huyết sau khi ăn.
- Giấm acid acetic giúp ngăn chặn sự tích tụ mỡ trong cơ thể và gan, giảm lượng calo đưa vào cơ thể để giảm mỡ cũng như giảm cân nặng cơ thể khá tốt.
- Giấm táo cũng có tác dụng chống lão hóa hiệu quả.
- Nhờ có phản ứng với kim loại tạo ra loại muối trung hòa, nên CH3COOH còn giúp làm tan sỏi trong thận.
II. C2H5OH
1. C2H5OH là gì?
C2H5OH là công thức hóa học của Etanol hay còn được biết tới với tên ancol etylic, rượu etylic, cồn…
C2H5OH nằm trong dãy đồng đẳng của rượu Metylic, không màu, dễ cháy và là thành phần trong các đồ uống có cồn.
Etanol là thành phần hóa học trong sản xuất các đồ uống có cồn.
2. Công thức của C2H5OH
C2H5OH có cấu trúc dạng mạch thẳng, công thức hóa học là C2-H5-OH nhưng có thể viết tắt là C2H6O
3. Tính chất vật lý
Rượu etylic là một chất lỏng, không màu, trong suốt, mùi thơm dễ chịu và đặc trưng, vị cay, nhẹ hơn nước (khối lượng riêng 0,7936 g/ml ở 15 độ C), dễ bay hơi (sôi ở nhiệt độ 78,39 độ C), hóa rắn ở -114,15 độ C, tan trong nước vô hạn, tan trong ete và clorofom, hút ẩm, dễ cháy, khi cháy không có khói và ngọn lửa có màu xanh da trời. Sở dĩ rượu etylic tan vô hạn trong nước và có nhiệt độ sôi cao hơn nhiều so với este hay aldehyde có khối lượng phân tử xấp xỉ là do sự tạo thành liên kết hydro giữa các phân tử rượu với nhau và với nước.
Etanol có tính khúc xạ hơi cao hơn so với của nước, với hệ số khúc xạ là 1,36242 (ở λ=589,3 nm và 18,35°C).
Điểm ba trạng thái của etanol là 150 K ở áp suất 4,3 × 10−4 Pa
4. Tính chất hóa học
Tính chất hóa học của etanol được quyết định bới cấu trúc phân tử
Với hóa học phổ thông, rượu etylic có 3 tính chất quan trọng nhất là phản ứng với kim loại kiềm, phản ứng cháy và phản ứng este hóa với axit axetic
Etylic C2H5OH phản ứng với oxi
Rượu etylic dễ cháy, khi cháy không có khói và ngọn lửa có màu xanh da trời, tỏa nhiều nhiệt
C2H5OH + 3O2 →to 2CO2 + 3H2O
Etanol C2H5OH tác dụng với Na, NaNH3
Etanol chỉ tác dụng với Na hay NaNH2
2C2H5OH + Na → 2C2H5ONa + H2↑
C2H5-OH + NaNH2 → C2H5-ONa + NH3
Etanol C H5OH phản ứng với axit axetic
Tổng quát phản ứng este hóa
ROH + R’COOH ↔ R’COOR + H2O
Phản ứng được thực hiện trong môi trường axit và đun nóng.
Phản ứng có tính thuận nghịch nên chú ý đến chuyển dịch cân bằng.
C2H5OH + CH3COOH ↔ CH3COOC2H5 + H2O
Etylic axit axetat Etylaxetat
**Nâng cao
Phản ứng với axit halogen
CH3-CH2-OH + HBr →H2SO4.CH3-CH2 -Br + H2O
CH3-CH2-OH + HCl →ZnCl2CH3-CH2 -Cl+ H2O
+ Khả năng phản ứng: HI > HBr > HCl > HF
+ Phản ứng tách nước
+ Phản ứng tách nước (đề hiđrat hóa) của etanol tạo thành etylen và nước.
C2H5OH → H2SO4 đặc, 170oC C2H4 + H2O
+ Phản ứng dehydro hóa (tách hidro)
CH3CH2OH→ Cu, 200-300o C CH3CHO + H2
+ Phản ứng oxi hóa không hoàn toàn
+ Tác nhân oxy hóa: KMnO4, K2Cr2O7, CrO3…
CH3-CH2OH+ KMnO4 → CH3-COOK + MnO2 + KOH
+ Phản ứng lên men giấm
+ Phản ứng oxi hóa không hoàn toàn với xúc tác là men giấm ở 25 độ C tạo thành axit axetic (giấm ăn)
C2H5OH + O2 →men giấm CH3COOH + H2O
Phản ứng tạo buta -1,3 - dien
2C2H5OH → Al2O3, ZnO, 450oC CH2=CH-CH=CH2 + 2H2O + H2
5. Các phương pháp điều chế ancol etylic
2 Phương pháp điều chế thông dụng nhất của etanol là lên men đường hoặc tinh bột và cộng hợp etylen với nước.
- Tinh bột hoặc đường → Rượu etylic.
C6H12O6 → 2CH3CH2OH + 2CO2
Cho etylen cộng hợp với nước có axit làm xúc tác
Tuân theo quy tắc Maccopnhicop
Phản ứng cần xúc tác acid: H2SO4, H3PO4 (không dùng HX)
CH2 = CH2 + H2O → C2H5OH
- Ngoài ra còn các phương pháp sau:
Cộng hidro vào andehit
CH3CHO + H2 →Ni, to CH3-CH2-OH
Thủy phân C2H5-X, dẫn xuất của este
C2H5X+ NaOH → C2H5OH +NaCl
CH3COOC2H5 + H2O → C2H5OH + CH3COOH
Ứng dụng của rượu etylic
Rượu etylic được dùng làm nhiên liệu cho động cơ ôtô, cho đèn cồn trong phòng thí nghiệm.
Trong công nghiệp dung làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp; dùng pha chế các loại rượu uống,..
III. Phản ứng este hóa
1. Phương trình điều chế etyl axetat
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Mở rộng: CH3COOC2H5 (etyl axetat) là chất lỏng, mùi thơm, ít tan trong nước, dùng làm dung môi trong công nghiệp
2. Điều kiện Điều chế etyl axetat
Nhiệt độ: 140°C Xúc tác: H2SO4 đặc
3. Tính chất hóa học este
Phản ứng thủy phân môi trường Axit (H+)
R-COO-R' + H-OH ⇋ R-COOH + R'-OH
Phản ứng thủy phân môi trường Bazơ (OH-)
R-COO-R' + NaOH ⟶ R-COONa + R'-OH
Ví dụ:
CH3COOC2H5 + NaOH ⟶ CH3COONa + C2H5OH
CH2=CH-COO-CH3 + NaOH ⟶ CH2= CH-COONa + CH3-OH
Phản ứng Este chứa gốc không no
Phản ứng H2(xt, Ni, to)
CH2=CH-COO-CH3 + H2 ⟶ C2H5COO-CH3
Phản ứng trùng hợp (tạo polime)
nCH3COOCH=CH2 ⟶ Poli (vinyl axetat)
nCH2=C(CH3)-COOCH3 ⟶ Thủy tinh hữu cơ
4. Điều chế este
- Thực hiện phản ứng este hóa giữa ancol và axit
RCOOH + R’OH ⟶ RCOOR’ + H2O
- Thực hiện phản ứng cộng giữa axit và hidrocacbon không no
CH3COOH + C2H2 ⟶ CH3COOCH=CH2
- Thực hiện phản ứng giữa phenol và anhidrit axit
(CH3CO)2O + C6H5OH ⟶ CH3COOH + CH3COOC6H5
-------------------------------
Ngoài Phản ứng C2H5OH + CH3COOH xảy ra như thế nào? đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.








