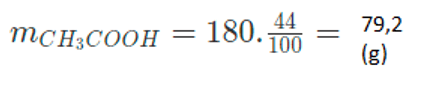Sơ đồ tư duy tính chất hóa học của axit
Sơ đồ tư duy tính chất hóa học của axit được chúng tôi sưu tầm và tổng hợp lí thuyết trong chương trình giảng dạy môn Hóa học lớp 9. Hi vọng rằng đây sẽ là những tài liệu hữu ích trong công tác giảng dạy và học tập của quý thầy cô và các bạn học sinh.
Lưu ý: Nếu bạn muốn Tải bài viết này về máy tính hoặc điện thoại, vui lòng kéo xuống cuối bài viết.
Sơ đồ tư duy tính chất hóa học của axit
Sơ đồ tư duy tính chất hóa học của axit
1. Axit là gì?
- Axit là một hợp chất hóa học có công thức HxA, có vị chua và tan được trong nước để tạo ra dung dịch có nồng độ pH < 7. Độ pH càng lớn thì tính axit càng yếu và ngược lại.
- Ngoài ra, còn một cách định nghĩa axit là gì khác như sau “ axit là các phân tử hay ion có khả năng nhường proton H+ cho bazo hoặc nhận các cặp electron không chia từ bazo”.
2. Có những loại axit nào? Phân loại axit
Axit được phân loại dự vào một số tiêu chí như sau:
2.1. Dựa vào tính chất hóa học của axit
- Axit mạnh: Axit clohydric HCl, axit sulfuric H2SO4, axit nitric HNO3,…
- Axit yếu: Hydro sunfua H2S, axit cacbonic H2CO3,…
2.2. Dựa vào nguyên tử oxy
- Axit không có oxi: HCl, H2S, HBr, HI, HF…
- Axit có oxi: H2SO4, HNO3, H3PO4, H2CO3…
2.3. Phân loại khác
- Axit vô cơ: HCl, H2SO4, HNO3,…
- Axit hữu cơ – RCOOH: CH3COOH, HCOOH,…
3. Cách xác định độ mạnh, yếu của axit
- Dựa vào sự linh động của nguyên tử Hydro trong axit đó. Nếu H càng linh động, tính axit càng mạnh và ngược lại.
- Với những axit có oxy trong cùng một nguyên tố, càng ít oxy, axit càng yếu
HClO4 > HClO3> HClO2> HClO
- Với những axit của nguyên tố trong cùng chu kỳ, khi các nguyên tố ở hóa trị cao nhất, nguyên tố trung tâm có tính phi kim càng yếu thì axit đó càng yếu.
HClO4> H2SO4> H3PO4
- Với axit của nguyên tố cùng nhóm A
+ Axit có oxy: Tính axit tăng dần từ dưới lên: HIO4 < HbrO4< HClO4
+ Axit không có oxy: Tính axit giảm dần từ dưới lên: HI > HBr> HCl> HF
- Với axit hữu cơ RCOOH
+ Nếu R đẩy electron (gốc R no) thì tính axit giảm
HCOOH> CH3COOH> CH3CH2COOH> CH3CH2CH2COOH> n-C4H9COOH.
+ Nếu R hút e (gốc R không no, thơm hoặc có nguyên tố halogen,…), tính axit sẽ mạnh
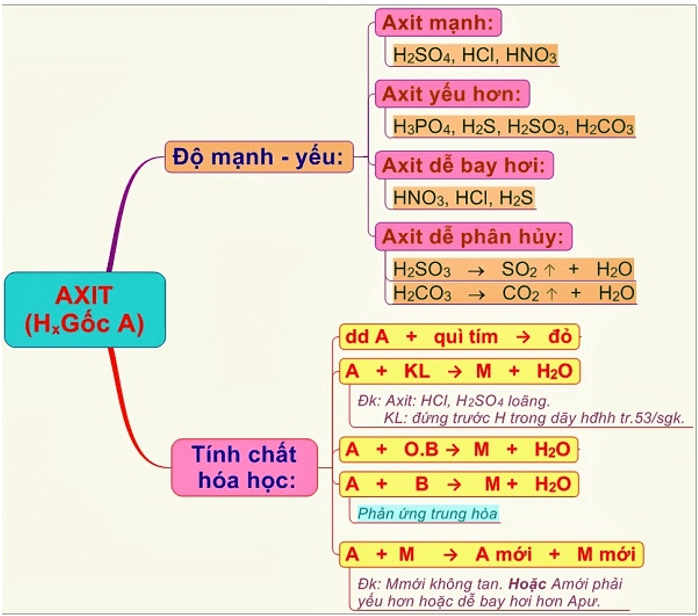
4. Những tính chất của axit
4.1 Tính chất vật lý của axit
- Tan trong nước, có vị chua.
- Khi tiếp xúc với axit mạnh, có cảm giác đau nhói.
- Là chất điện li nên có thể dẫn điện.
4.2 Tính chất hóa học của axit
- Làm đổi màu chất chỉ thị (quỳ tím, giấy chỉ thị pH, dung dịch phenol phtalein).
- Tác dụng được với một số kim loại tạo thành muối và giải phóng hydro. Đối với axit sulfuric và axit nitric đặc nóng có thể tác dụng với hầu hết các kim loại, tạo khí lưu huỳnh dioxit SO2(H2SO4) hoặc nito dioxit NO2(HNO3)
HCl + Fe -> FeCl2 + H2
2Fe + 6H2SO4 -> Fe2(SO4)3 + 6H2O + 3SO2
- Tác dụng với bazo tạo thành muối và nước
Cu(OH)2 + H2SO4 -> CuSO4 + 2H2O
- Tác dụng với oxit bazơ tạo thành muối + nước
Na2O + 2HCl → 2NaCl + H2
FeO + H2SO4(loãng) → FeSO4 + H2O
CuO + 2HCl → CuCl2 + H2O
- Tác dụng với muối tạo muối mới và axit mới
4.3 Điều kiện xảy ra phản ứng
- Muối phản ứng là muối tan.
- Muối mới không tan trong axit mới.
- Sản phẩm có chứa một chất kết tủa hoặc bay hơi.
H2SO4 + BaCl2 → BaSO4(r) + 2HCl
K2CO3 + 2HCl → 2KCl + H2O + CO2
(axit cacbonic phân hủy ra nước và khí cacbonic)
Axit axetic
Công thức phân tử: C2H4O2
Phân tử khối: 60
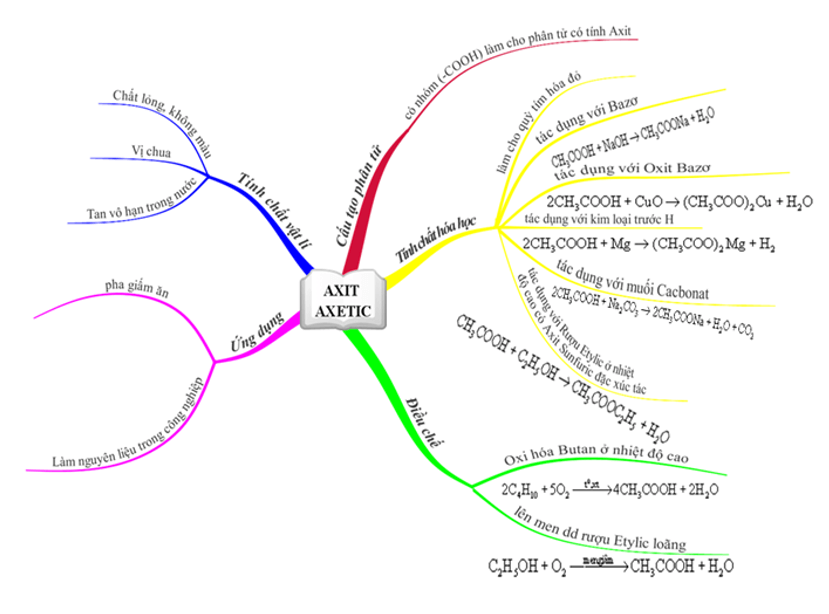
Tính chất vật lí của Axit axetic
- Axit axetic là chất lỏng, không màu, vị chua, tan vô hạn trong nước.
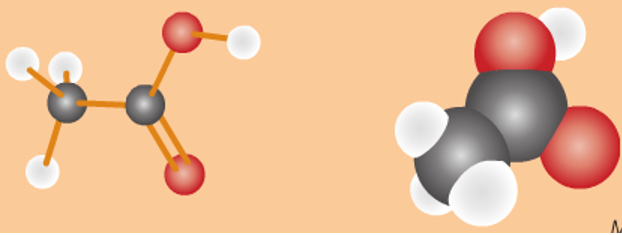
Cấu tạo phân tử của Axit axetic
Mô hình phân tử của Axit axetic ở dạng rỗng và đặc
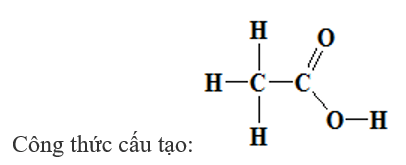
- Công thức rút gọn: CH3 – COOH
- Nhóm (–COOH) này làm cho phân tử có tính axit
Tính chất hóa học của Axit axetic
Axit axetic có tính chất của một axit không?
- Axit axetic là một axit hữu cơ mang tính chất của một axit. Tuy nhiên, axit axetic là một axit yếu.
- Làm hóa hồng quỳ tím
- Tác dụng với kim loại:
2CH3COOH + Zn → (CH3COO)2Zn + H2↑ (có sủi bọt khí không màu)
- Tác dụng với bazơ:
CH3COOH + NaOH → CH3COONa + H2O
(chứng minh phản ứng đã xảy ra bằng cách cho chất chỉ thị màu phenolphtalein vào dung dịch kiềm trước thấy dung dịch màu hồng, sau đó kiềm bị trung hòa bởi axit làm màu hồng nhạt dần rồi mất hẳn)
- Tác dụng với oxit bazơ:
2CH3COOH + CuO (bột, màu đen) → (CH3COO)2Cu + H2O (dung dịch Cu2+ màu xanh lam)
- Tác dụng với muối:
2CH3COOH + CaCO3 → (CH3COO)2Ca + CO2↑ + H2O (có sủi bọt khí không màu)
- Một số video tiến hành các phản ứng minh họa cho tính axit của CH3COOH như sau:
Axit axetic có phản ứng với rượu etylic không?
- Cách tiến hành: Các em chú ý quan sát thí nghiệm sau:
- Hiện tượng: Trong ống nghiệm có chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
- Giải thích: Rượu etylic tác dụng với axit axetic tạo etyl axetat theo phản ứng
C2H5OH + CH3COOH CH3COOC2H5 + H2O
Điều chế
Sơ đồ tư duy bài Axit axetic
Bài tập minh họa
Bài 1: Cho 180 gam axit axetic tác dụng với 138 gam rượu etylic (có xúc tác axit). Sau khi phản ứng hoàn toàn đã có 44% lượng axit chuyển thành este. Tính khối lượng các chất thu được sau phản ứng.
Hướng dẫn:
- Lượng axit axetic tham gia phản ứng là:
- Khối lượng axit axetic còn lại là: 180 – 79,2 = 108,8 (gam)
- Khối lượng rượu etylic còn lại là: 138 – 60,72 = 77,28 (gam)
- Khối lượng este thu được là: 116,16 (gam)
-------------------------------
Ngoài Sơ đồ tư duy tính chất hóa học của axit đã được VnDoc giới thiệu, mời các bạn cùng tham khảo thêm Chuyên đề Hóa học lớp 9, Trắc nghiệm Hóa học 9, Lý thuyết môn Hóa học lớp 9 để hoàn thành tốt chương trình học THCS.
Ngoài ra, VnDoc.com đã thành lập group chia sẻ tài liệu học tập THCS miễn phí trên Facebook: Tài liệu học tập lớp 9. Mời các bạn học sinh tham gia nhóm, để có thể nhận được những tài liệu mới nhất.