Lý thuyết Kim loại: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
Chuyên đề Hóa học 12 Lý thuyết Kim loại: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng. Hy vọng qua bộ tài liệu các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Lý thuyết Kim loại
1. Vị trí, cấu tạo của kim loại
a. Vị trí
- Nhóm IA (trừ H), nhóm IIA: các kim loại này là những nguyên tố s.
- Nhóm IIIA (trừ B), một phần của các nhóm IVA, VA, VIA: các kim loại này là những nguyên tố p.
- Các nhóm B (từ IB đến VIIIB): các kim loại chuyển tiếp, chúng là những nguyên tố d.
- Họ lantan và actini (xếp riêng thành hai hàng ở cuối bảng): các kim loại thuộc hai họ này là những nguyên tố f.
b. Cấu tạo
- Cấu tạo nguyên tử kim loại.
+ Hầu hết các nguyên tử kim loại có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
+ Bán kính nguyên tử của các nguyên tố kim loại nhìn chung lớn hơn bán kính nguyên tử các nguyên tố phi kim.
- Cấu tạo mạng tinh thể kim loại.
Có ba kiểu mạng tinh thể kim loại đặc trưng là lập phương tâm khối, lập phương tâm diện và lục phương.
- Liên kết kim loại
Là liên kết hóa học hình thành bởi lực hút tĩnh điện giữa ion dương kim loại nằm ở các nút mạng tinh thể và các electron tự do di chuyển trong toàn bộ mạng lưới tinh thể kim loại.
2. Tính chất vật lý của kim loại
- Kim loại có tính chất vật lí chung là dẻo, dẫn điện, dẫn nhiệt và có ánh kim.
- Một số tính chất vật lí riêng:
* Tỉ khối: của các kim loại rất khác nhau nhưng thường dao động từ 0,5 (Li) đến 22,6 (Os). Thường thì:
+ d < 5: kim loại nhẹ (K, Na, Mg, Al).
+ d > 5: kim loại nặng (Zn, Fe...).
* Nhiệt độ nóng chảy: biến đổi từ -39oC (Hg) đến 3410oC (W). Thường thì:
+ t < 10000C: kim loại dễ nóng chảy.
+ t > 15000C: kim loại khó nóng chảy (kim loại chịu nhiệt).
* Tính cứng: Biến đổi từ mềm đến rất cứng.
Tỷ khối, nhiệt độ nóng chảy và tính cứng của kim loại phụ thuộc vào nhiều yếu tố như kiểu mạng tinh thể; mật độ e; khối lượng mol của kim loại...
3. Tính chất hóa học của kim loại
Tính chất đặc trưng của kim loại là tính khử (nguyên tử kim loại dễ bị oxi hóa thành ion dương): M → Mn+ + ne.
a. Tác dụng với phi kim
Hầu hết các kim loại khử được phi kim điển hình thành ion âm.
Ví dụ:
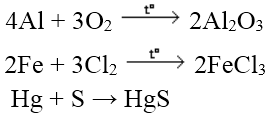
b. Tác dụng với axit
- Đối với dung dịch HCl, H2SO4 loãng:
M + nH+ → Mn+ + n/2H2
(M đứng trước hiđro trong dãy thế điện cực chuẩn).
- Đối với H2SO4 đặc, HNO3 (axit có tính oxi hóa mạnh):
+ Kim loại thể hiện nhiều số oxi hóa khác nhau khi phản ứng với H2SO4 đặc, HNO3 sẽ đạt số oxi hóa cao nhất.
+ Hầu hết các kim loại phản ứng được với HNO3 và H2SO4 đặc (trừ Pt, Au).
Lưu ý: Fe, Al, Cr bị thụ động hóa trong H2SO4 và HNO3 đặc nguội.
Khi đó S
+6 H2SO4 bị khử thành S+4 (SO2); So hoặc S-2 (H2S)
Trong HNO3 đặc N+5 bị khử thành N+4 (NO2)
Với HNO3 loãng N+5 bị khử thành N+2(NO); N+1 (N2O); No (N2); N-3 (NH4+)
+ Các kim loại có tính khử càng mạnh thường cho sản phẩm khử có số oxi hóa càng thấp. Các kim loại như Na, K... sẽ gây nổ khi tiếp xúc với các dung dịch axit
Ví dụ:
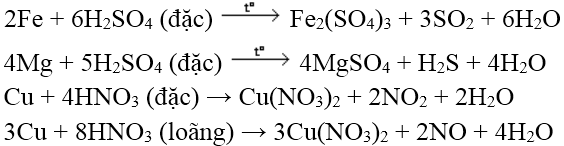
c. Tác dụng với dung dịch muối
- Với Na, K, Ca và Ba phản ứng với nước trước sau đó dung dịch kiềm tạo thành sẽ phản ứng với muối.
- Với các kim loại không tan trong nước, kim loại hoạt động đẩy được kim loại kém hoạt động ra khỏi dung dịch muối của chúng theo quy tắc α.
Fe + CuSO4 → FeSO4 + Cu
Chú ý:
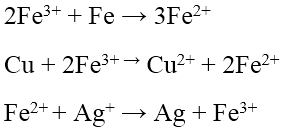
d. Tác dụng với dung dịch kiềm
Các kim loại mà hiđroxit của chúng có tính lưỡng tính như Al, Zn, Be, Sn, Pb... tác dụng được với dung dịch kiềm (đặc).
2Al + 6H2O + 2NaOH → 2Na[Al(OH)4] + 3H2
e. Tác dụng với oxit kim loại
Các kim loại mạnh khử được các oxit kim loại yếu hơn ở nhiệt độ cao thành kim loại
Ví dụ:
![]()
4. Điều chế
Nguyên tắc điều chế: Khử ion kim loại thành kim loại
Mn+ + ne → M
* Một số phương pháp điều chế
a. Phương pháp nhiệt luyện
- Nguyên tắc: dùng chất khử CO, C, Al, H2 khử oxit kim loại ở nhiệt độ cao.
- Phạm vi sử dụng: thường dùng trong công nghiệp với kim loại sau Al.
Ví dụ:
PbO + C → Pb + CO
Fe2O3 + 3CO → 2Fe + 3CO2
b. Phương pháp thủy luyện
- Nguyên tắc: Dùng dung dịch thích hợp (HCl, HNO3, nước cường toan, CN-...) hòa tan nguyên liệu sau đó lấy kim loại mạnh (không tan trong nước) đẩy kim loại yếu khỏi dung dịch của nó.
- Phạm vi sử dụng: thường dùng trong phòng thí nghiệm để điều chế các kim loại sau Mg (thường là kim loại yếu).
Ví dụ:
Vàng lẫn trong đất đá có thể hòa tan dần trong dung dịch NaCN cùng với oxi của không khí, được dung dịch muối phức của vàng:
4Au + 8NaCN + O2 + 2H2O → 4Na[Au(CN)2] + 4NaOH
Sau đó, ion Au3+ trong phức được khử bằng kim loại Zn:
Zn + 2Na[Au(CN)2] → Na2[Zn(CN)4] + 2Au
c. Phương pháp điện phân
- Điện phân nóng chảy
+ Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại trong chất điện li nóng chảy (muối halogenua, oxit, hidroxit).
+ Phạm vi sử dụng: có thể dùng để điều chế tất cả các kim loại nhưng thường dùng với kim loại mạnh: K, Na, Mg, Ca, Ba và Al.
- Điện phân dung dịch
+ Nguyên tắc: Dùng dòng điện một chiều khử ion kim loại yếu trong dung dịch muối của nó.
+ Phạm vi sử dụng: Dùng điều chế các kim loại yếu.
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Dạng bài tập về phản ứng trùng ngưng tạo Polime
- Sơ đồ điều chế Cao su Buna
- Sơ đồ điều chế PVC
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Cơ bản - phần 1)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Cơ bản - phần 2)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Nâng cao - phần 1)
- 50 câu trắc nghiệm Polime và vật liệu Polime có lời giải chi tiết (Nâng cao - phần 2)
Trên đây VnDoc đã giới thiệu tới các bạn Lý thuyết Kim loại: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








