Bài toán về phản ứng đốt cháy Este
VnDoc mời các bạn tham khảo Bài toán về phản ứng đốt cháy Este. Chắc chắn tài liệu sẽ giúp các bạn giải Hóa 12 hiệu quả hơn.
Hóa học 12: Bài toán về phản ứng đốt cháy Este
A. Lý thuyết và Phương pháp giải
CTTQ este: CnH2n+2-2k-2xO2x
PT tổng quát

TH este no, đơn chức ![]()
⇒ ![]() \(n_{H_2O}\)=
\(n_{H_2O}\)= ![]() \(n_{CO_2}\) ; neste = 1,5
\(n_{CO_2}\) ; neste = 1,5![]() \(n_{CO_2}\) -
\(n_{CO_2}\) - ![]() \(n_{O_2}\)
\(n_{O_2}\)
⇒ Số nguyên tử C là 
Trường hợp đốt cháy một hỗn hợp nhiều este thuộc cùng dãy đồng đẳng thì ta cũng kết luận tương tự như trên.
nhỗn hợp = 1,5![]() \(n_{CO_2}\) -
\(n_{CO_2}\) - ![]() \(n_{O_2}\)
\(n_{O_2}\)

ở đây:  với nmin < n– < nmax khác với axit cacboxylic giá trị n– trong este luôn lớn hơn 2.
với nmin < n– < nmax khác với axit cacboxylic giá trị n– trong este luôn lớn hơn 2.
Ví dụ minh họa
Bài 1: Đốt cháy hoàn toàn 7,4 gam este X đơn chức thu được 6,72 lít khí CO2 (đktc) và 5,4 gam nước. Xác định công thức phân tử của X.
Hướng dẫn:
Ta có: ![]() \(n_{CO_2}\) = 6,72/22,4 = 0,3 (mol) và
\(n_{CO_2}\) = 6,72/22,4 = 0,3 (mol) và ![]() \(n_{H_2O}\) = 5,4/18 = 0,3 (mol)
\(n_{H_2O}\) = 5,4/18 = 0,3 (mol)
Vì khi đốt cháy X thu được ![]() \(n_{H_2O}\) =
\(n_{H_2O}\) = ![]() \(n_{CO_2}\) nên X là este no đơn chức
\(n_{CO_2}\) nên X là este no đơn chức
Gọi công thức của este no, đơn chức là: CnH2nO2 (n ≥ 2)

Theo đề bài, ta có: MX = (0,3/n).(14n + 32) = 7,4 ⇒ n = 3
Vậy công thức phân tử của X là: C3H6O2.
Bài 2: Đốt cháy hoàn toàn 1,76 gam một este X thu được 3,52 gam CO2 và 1,44 gam H2O. Xác định công thức phân tử của X?
Hướng dẫn:
Ta có: ![]() \(n_{CO_2}\)= 3,52/44 = 0,08 (mol);
\(n_{CO_2}\)= 3,52/44 = 0,08 (mol); ![]() \(n_{H_2O}\) = 1,44/18 = 0,08(mol)
\(n_{H_2O}\) = 1,44/18 = 0,08(mol)
Do ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{H_2O}\) ⇒ X có độ bất bão hòa của phân tử ∆ = 1
\(n_{H_2O}\) ⇒ X có độ bất bão hòa của phân tử ∆ = 1
X là este no, đơn chức ⇒ X dạng CnH2nO2

Vậy công thức phân tử của X là: C4H8O2
Bài 3: Đốt cháy hoàn toàn 4,2 gam một este E thu được 6,16 gam CO2 và 2,52 gam H2O. Xác định công thức phân tử, công thức cấu tạo, gọi tên E.
Hướng dẫn:
Ta có; ![]() \(n_{CO_2}\) = 6,16/44 = 0,14(mol);
\(n_{CO_2}\) = 6,16/44 = 0,14(mol); ![]() \(n_{H_2O}\) = 2,52/18 = 0,14 (mol)
\(n_{H_2O}\) = 2,52/18 = 0,14 (mol)
Do ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{H_2O}\) ⇒ ∆ = 1 ⇒ E là este no, đơn chức dạng: CnH2nO2
\(n_{H_2O}\) ⇒ ∆ = 1 ⇒ E là este no, đơn chức dạng: CnH2nO2

n = 2 ⇒ C2H4O2 ⇒ CTPT của E là HCOOCH3 (metyl fomiat)
Bài 4: Đốt cháy hoàn toàn một lượng hỗn hợp hai este, cho sản phẩm phản ứng cháy qua bình đựng P2O5 dư, khối lượng bình tăng thêm 6,21 gam, sau đó cho qua tiếp dung dịch Ca(OH)2 dư, thu được 34,5 gam kết tủa. Các este nói trên thuộc loại gì (đơn chức hay đa chức, no hay không no)?
Hướng dẫn:
Khối lượng tăng lên của bình P2O5 là khối lượng H2O
P2O5 + 3H2O → 2H3PO4
Có kết tủa tạo thành là do CO2 hấp thụ
CO2 + Ca(OH)2 → CaCO3 + H2O
Ta có: ![]() \(n_{_{CaCO_3}}\)= 34,5/100 = 0,345 (mol)
\(n_{_{CaCO_3}}\)= 34,5/100 = 0,345 (mol)
![]() \(n_{H_2O}\) = 6,21/18 = 0,345 (mol);
\(n_{H_2O}\) = 6,21/18 = 0,345 (mol); ![]() \(n_{CO_2}\) = nCaCO3 = 0,345 (mol)
\(n_{CO_2}\) = nCaCO3 = 0,345 (mol)
Số mol H2O = số mol của CO2 ⇒ ∆ = 1
Do đó, hai este đều no, đơn chức
Bài 5: Đốt cháy hoàn toàn 3,7 gam một este đơn chức X thu được 3,36 lít khí CO2 (đktc) và 2,7 gam nước. Tìm công thức phân tử của X.
Hướng dẫn:
ta có: ![]() \(n_{CO_2}\) = 3,36/22,4 = 0,15 (mol) và
\(n_{CO_2}\) = 3,36/22,4 = 0,15 (mol) và ![]() \(n_{H_2O}\) = 2,7/18 = 0,15 (mol)
\(n_{H_2O}\) = 2,7/18 = 0,15 (mol)
Vì ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{H_2O}\) ⇒ este no, đơn chức
\(n_{H_2O}\) ⇒ este no, đơn chức
Gọi công thức este no, đơn chức là: CnH2nO2 (n ≥ 2)
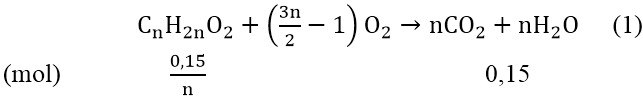
Theo đề bài, ta có phương trình:
mX = (0,15/n).(14n + 32) = 3,7 ⇒ 2,1n + 4,8 = 3,7n ⇒ n = 3
Vậy công thức phân tử của X là: C3H6O2
B. Bài tập trắc nghiệm
Bài 1: Hỗn hợp X gồm 2 este no, đơn chức, mạch hở. đốt cháy hoàn toàn một lượng X cần dùng vừa đủ 3,976 lít khí oxi (đktc), thu được 6,38 gam CO2. Mặt khác, X tác dụng với dung dịch NaOH, thu được một muối và hai ancol là đồng đẳng kế tiếp. Công thức phân tử của hai este trong X là:
A. C2H4O2 và C5H10O2
B. C2H4O2 và C3H6O2
C. C3H4O2 và C4H6O2
D. C3H6O2 và C4H8O2
Đáp án: B
Khi thủy phân X bời dung dịch NaOH, thu được muối và hai ancol là đồng đẳng liên tiếp X gồm hai este no, đơn chức, mạch hở đồng đẳng kế tiếp.
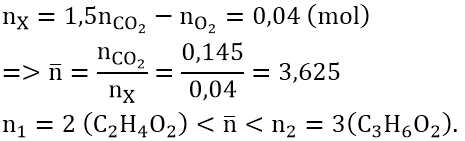
Bài 2: Đốt cháy hoàn toàn 10 ml một este cần dùng hết 45 ml O2, thu được ![]() \(V_{CO_2}\) :
\(V_{CO_2}\) : ![]() \(V_{H_2O}\) = 4 : 3. Ngưng tụ sản phẩm cháy thấy thể tích giảm 30 ml. Các thể tích đo ở cùng điều kiện. Công thức của este đó là:
\(V_{H_2O}\) = 4 : 3. Ngưng tụ sản phẩm cháy thấy thể tích giảm 30 ml. Các thể tích đo ở cùng điều kiện. Công thức của este đó là:
A. C8H6O4.
B. C4H6O2.
C. C4H8O2
D. C4H6O4.
Đáp án: B
Đối với các chất khi và hơi, tỉ lệ về thể tích bằng tỉ lệ về số mol nên có thể áp dụng định luật bảo toàn nguyên tố theo thể tích của các chất.
Theo giả thiết suy ra: ![]() \(V_{H_2O}\) = 30 ml ;
\(V_{H_2O}\) = 30 ml ; ![]() \(V_{CO_2}\) = 40 ml
\(V_{CO_2}\) = 40 ml
Sơ đồ phản ứng:
CxHyOz + O2 → CO2 + H2O
Áp dụng định luật bảo toàn nguyên tố cho các nguyên tố C, H, O ta có:
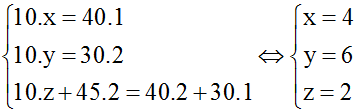
Bài 3: Đốt cháy hoàn toàn 2,28 gam X cần 3,36 lít oxi (đktc) thu hỗn hợp CO2 và H2O có tỉ lệ thể tích tương ứng 6 : 5. Nếu đun X trong dung dịch H2SO4 loãng thu được axit Y có ![]() \(d_{Y/H_2}\)và ancol đơn chức Z. Công thức của X là:
\(d_{Y/H_2}\)và ancol đơn chức Z. Công thức của X là:
A. C2H5COOC2H5.
B. CH3COOCH3.
C. C2H3COOC2H5.
D. C2H3COOC3H7.
Đáp án: D
Vì ![]() \(V_{CO_2}\) :
\(V_{CO_2}\) : ![]() \(V_{H_2O}\) =
\(V_{H_2O}\) = ![]() \(n_{CO_2}\) :
\(n_{CO_2}\) : ![]() \(n_{H_2O}\) = 6 : 5 ⇒ nC : nH = 6 : 10 = 3 : 5.
\(n_{H_2O}\) = 6 : 5 ⇒ nC : nH = 6 : 10 = 3 : 5.
Bài 4: Đốt cháy hoàn toàn 0,11 gam một este X (tạo nên từ một axit cacboxylic đơn chức và một ancol đơn chức) thu được 0,22 gam CO2 và 0,09 gam H2O. Số este đồng phân của X là:
A. 2.
B. 5.
C. 6.
D. 4.
Đáp án: D
Số mol CO2 bằng số H2O bằng 0,005 nên X là este no, đơn chức CnH2nO2.
CnH2nO2 →![]() \(n_{CO_2}\)
\(n_{CO_2}\)
Ta có hệ:
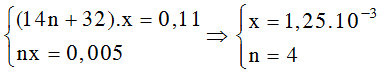
Số este đồng phân của X là 4.
HCOOCH2CH2CH3 ; HCOOCH(CH3)CH3 ; CH3COOCH2CH3 ; CH3CH2COOCH3.
Bài 5: Hỗn hợp X gồm vinyl axetat, metyl axetat và etyl fomat. Đốt cháy hoàn toàn 3,08 gam X, thu được 2,16 gam H2O. Phần trăm số mol của vinyl axetat trong X là:
A. 25%.
B. 27,92%.
C. 72,08%.
D. 75%.
Đáp án: A
Hỗn hợp X gồm CH3COOCH=CH2; CH3COOCH3; HCOOC2H5.
Đặt công thức chung của ba chất là ![]()
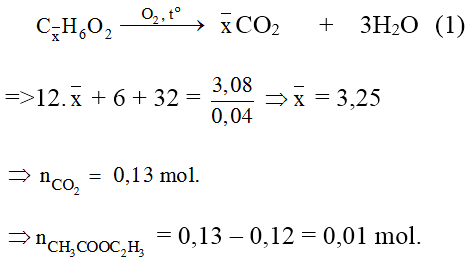
Phần trăm về số mol của CH3COOC2H3 = 25%.
Bài 6: Đốt cháy hoàn toàn 3,42 gam hỗn hợp gồm axit acrylic, vinyl axetat, metyl acrylat và axit oleic, rồi hấp thụ toàn bộ sản phẩm cháy vào dung dịch Ca(OH)2 (dư). Sau phản ứng thu được 18 gam kết tủa và dung dịch X. Khối lượng X so với khối lượng dung dịch Ca(OH)2 ban đầu đã thay đổi như thế nào?
A. Tăng 2,70 gam.
B. Giảm 7,74 gam.
C. Tăng 7,92 gam.
D. Giảm 7,38 gam.
Đáp án: D
Các chất đề cho đều có dạng CnH2n-2O2. Đặt công thức phân tử trung bình của các chất là
![]()
Sơ đồ phản ứng:
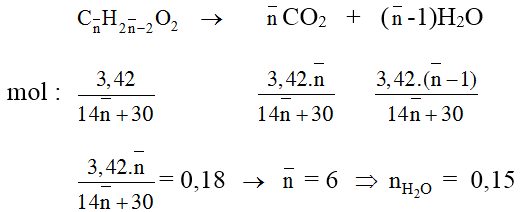
Vậy dung dịch sau phản ứng giảm so với dung dịch X là:
![]() \(m_{CaCO_3}\) - (
\(m_{CaCO_3}\) - (![]() \(m_{CO_2}\) +
\(m_{CO_2}\) + ![]() \(m_{H_2O}\)) = 7,38 gam.
\(m_{H_2O}\)) = 7,38 gam.
Bài 7: Đốt cháy 6 gam este E thu được 4,48 lít CO2 (đktc) và 3,6 gam H2O. Biết E có phản ứng tráng gương với dung dịch AgNO3/NH3. Công thức cấu tạo của E là:
A. CH3COOCH2CH2CH3.
B. HCOOCH2CH2CH3.
C. HCOOC2H5.
D. HCOOCH3.
Đáp án: D
Đốt cháy E thu được mol nên E là este no, đơn chức, mạch hở có công thức phân tử là CnH2nO2.
Sơ đồ phản ứng:

E là C2H4O2(HCOOCH3).
Bài 8: Đốt cháy hoàn toàn 0,1 mol X chỉ chứa nhóm chức este ta thu được 4.48 lít CO2(đktc) và 3,6 gam H2O. CTPT của este X có thể là:
A. C6H8O2
B. C4H8O4
C. C2H4O2
D. C3H6O2
Đáp án: C
Ta có: ![]() \(n_{CO_2}\) = 4,48/22,4 = 0,2 (mol);
\(n_{CO_2}\) = 4,48/22,4 = 0,2 (mol); ![]() \(n_{H_2O}\) = 3,6/18 = 0,2 (mol)
\(n_{H_2O}\) = 3,6/18 = 0,2 (mol)
0,1 mol este khi chát tạo ra 0,2 mol CO2 và 0,2 mol H2O nên este là C2H4O2.
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Lý thuyết Este: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng
- Lý thuyết Lipit: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng
- Lý thuyết Chất giặt rửa
- Lý thuyết Các phản ứng hóa học của Este, Lipit
- Lý thuyết luyện tập: Mối liên hệ giữa hiđrocacbon và một số dẫn xuất của hiđrocacbon
- Tính chất hóa học và tên gọi của Este
- Các phản ứng hóa học của Este
- Cách điều chế, nhận biết Este
Trên đây VnDoc đã giới thiệu tới các bạn Bài toán về phản ứng đốt cháy Este. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








