Xác định công thức phân tử Cacbohidrat
Chuyên đề Hóa học 12 Xác định công thức phân tử Cacbohidrat. Nội dung tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 nhanh và chính xác hơn. Mời các bạn tham khảo.
Hóa học 12: Xác định công thức phân tử Cacbohidrat
A. Phương pháp và ví dụ xác định công thức phân tử Cacbohidrat
Lý thuyết và Phương pháp giải
Thông qua các phản ứng đặc trưng để xác định nhóm chức có trong phân tử. Từ đó xác định công thức phân tử, viết công thức của gluxit cần xác định.
Ví dụ minh họa
Bài 1: Đốt cháy hoàn toàn 0,855 gam một chất đường thì thu được 1,32 gam CO2 và 0,495 gam H2O. Phân tử khối của đường trên gấp 1,9 lần phân tử khối glucozơ. Tìm công thức của đường.
Hướng dẫn:
Ta có: mC = 3/11.![]() \(m_{CO_2}\) = 0,36 (gam); mH = 1/2.
\(m_{CO_2}\) = 0,36 (gam); mH = 1/2.![]() \(m_{H_2O}\) = 0,055 (gam)
\(m_{H_2O}\) = 0,055 (gam)
⇒ mO = 0,855 - 0,055 = 0,44(gam)
Gọi công thức tổng quát: CxHyOz (M = 1,9.180 = 342)
Lập tỉ lệ: 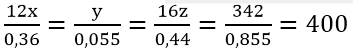
⇒ x = 12; y = 22; z = 11
Vậy công thức phân tử là C12H22O11
Bài 2: Đốt cháy hoàn toàn 16,2 gam một cacbohidrat X thu được 13,44 lít khí CO2 (đktc) và 9 gam nước. Tìm công thức đơn giản nhất của X và X thuộc loại cacbohidrat nào đã học.
Hướng dẫn:
Ta có: mC = 13,44/22,4.12 = 7,2 (gam); mH = 9/18.2 = 1 (gam)
Và mO = 16,2 - (7,2 + 1) = 8(gam)
Lập tỉ lệ: 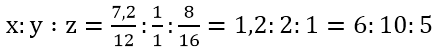
Công thức nguyên của X: (C6H10O5)n và X thuộc loại polisaccarit.
Bài 3: Đốt cháy hoàn toàn 0,0855 gam một cacbohiđrat X. Sản phẩm được dẫn vào nước vôi trong thu được 0,1 gam kết tủa và dung dịch A, đồng thời khối lượng dung dịch tăng 0,0815 gam. Đun nóng dung dịch A lại được 0,1 gam kết tủa nữa. Biết khi làm bay hơi 0,4104 gam X thu được thể tích khí đúng bằng thể tích 0,0552 gam hỗn hợp hơi ancol etylic và axit fomic đo trong cùng điều kiện. Công thức phân tử của X là:
A. C12H22O11.
B. C6H12O6.
C. (C6H10O5)n.
D. C18H36O18.
Hướng dẫn:
Đặt CTTQ của X: Cn(H2O)m.
![]()
CO2 + Ca(OH)2 → CaCO3 + H2O (2)
2CO2 + Ca(OH)2 → Ca(HCO3)2 (3)
Ca(HCO3)2 → CaCO3 + CO2 + H2O (4)
Theo (2) : ![]() \(n_{_{CO_2}}\) (pư) =
\(n_{_{CO_2}}\) (pư) = ![]() \(n_{CaCO_3}\) = 0,001 mol
\(n_{CaCO_3}\) = 0,001 mol
Theo (3), (4): ![]() \(n_{_{CO_2}}\) (pư) =
\(n_{_{CO_2}}\) (pư) = ![]() \(2.n_{Ca(HCO_3)_2}\) =
\(2.n_{Ca(HCO_3)_2}\) = ![]() \(2.n_{CaCO_3}\) = 0,002 mol
\(2.n_{CaCO_3}\) = 0,002 mol
Tổng số mol CO2 sinh ra từ phản ứng đốt cháy hợp chất hữu cơ là 0,003 mol.
Vì khối lượng dung dịch A tăng so với khối lượng dung dịch Ca(OH)2 ban đầu là 0,0815 gam nên ta có:
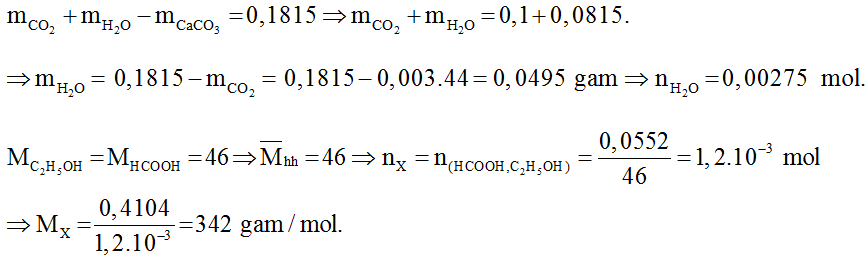
Mặt khác X có công thức là Cn(H2O)m nên suy ra:
12n + 18m = 342 ⇒ n = 12; m = 11.
Vậy, công thức phân tử của X là C12(H2O)11 hay C12H22O11.
B. Bài tập trắc nghiệm xác định công thức phân tử Cacbohidrat
Bài 1: Đốt cháy hoàn toàn 0,01 mol một cacbohidrat X thu được 5,28 gam CO2 và 1,98 gam H2O. Tìm công thức phân tử của X, biết rằng tỉ lệ khối lượng H và O trong A là: MH : mO = 0,125:1
A. C6H10O5
B. C6H12O6
C. C12H22O11
D. C5H10O5
Đáp án: C
Đặt công thức phân tử của cacbohidrat X là CxHyOz
Phương trình hóa học
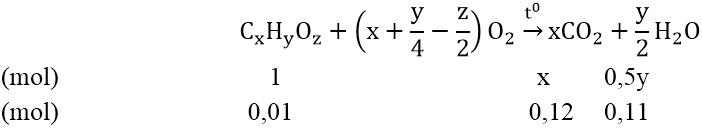
Từ lập luận trên ta có: x = 12; y = 22
Theo đề bài:
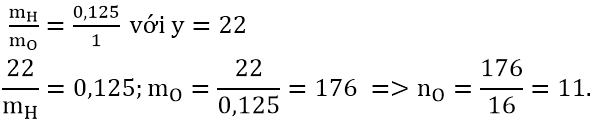
Công thức phân tử X: C12H22O11
Bài 2: Một hợp chất hữu cơ (X) có %C = 40,0; %H = 6,7 và % O = 53,3. Xác định công thức đơn giản nhất của X. biết rằng MX = 180. Xác định công thức phân tử của X.
A. C6H10O6
B. C12H22O11
C. C6H12O6
D. C6H10O5
Đáp án: C
Giả sử công thức phân tử của (X) là CxHyOz
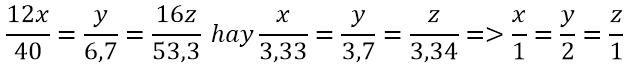
Vậy công thức đơn giản nhất của (X) là: CH2OH và công thức phân tử là Cn(H2O)n. Đây là công thức chung của monosaccarit với số phân tử H2O bằng số nguyên tử cacbon.
Với M = 180, ta có: (12 + 18)n = 180 ⇒ n = 6
Vậy công thức phân tử là: C6H12O6
Bài 3: Khi đốt cháy một cacbohiđrat X được ![]() \(m_{H_2O}\) :
\(m_{H_2O}\) : ![]() \(m_{CO_2}\) = 33:88. Công thức phân tử của X là
\(m_{CO_2}\) = 33:88. Công thức phân tử của X là
A. C6H12O6.
B. C12H22O11.
C. (C6H10O5)n.
D. Cn(H2O)m.
Đáp án: B
Ta có: ![]() \(m_{H_2O}\) :
\(m_{H_2O}\) : ![]() \(m_{CO_2}\) = 33:88 ⇒ H : C = = 11 : 6
\(m_{CO_2}\) = 33:88 ⇒ H : C = = 11 : 6
⇒ X là C12H22O11.
Bài 4: Hợp chất A là chất bột màu trắng không tan trong nước, trương lên trong nước nóng tạo thành hồ. Sản phẩm cuối cùng của quá trình thủy phân là chất B. Dưới tác dụng của enzim của vi khuẩn axit lactic, chất B tạo nên chất C có hai loại nhóm chức hóa học. Chất C có thể được tạo nên khi sữa bị chua. Xác định hợp chất A?
A. Tinh bột
B. Saccarozơ
C. Xenlulozơ
D. Mantozơ
Đáp án: A
Chất C là axit lactic (CH3CHOHCOOH)
Chất B là glucozo ⇒ A là tinh bột
Bài 5: Xenlulozơ điaxetat (X) được dùng để sản xuất phim ảnh hoặc tơ axetat. Công thức đơn giản nhất (công thức thực nghiệm) của X là:
A. C3H4O2
B. C10H14O7
C. C12H14O7
D. C12H14O5
Đáp án: B
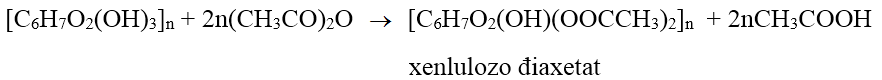
⇒ Công thức đơn giản nhất là C10H14O7
Bài 6: Đốt cháy hoàn toàn 10,26 gam một cacbohiđrat X thu được 8,064 lít CO2 (ở đktc) và 5,94 gam H2O. X có M < 400 và có khả năng phản ứng tráng gương. Tên gọi của X là
A. glucozơ.
B. saccarozơ.
C. fructozơ.
D. mantozơ.
Đáp án: D
![]() \(n_{CO_2}\)= 0,36 mol ;
\(n_{CO_2}\)= 0,36 mol ; ![]() \(n_{H_2O}\)= 0,33 mol
\(n_{H_2O}\)= 0,33 mol
Bảo toàn khối lượng ⇒ m O = 10,26 - ![]() \(12n_{_{CO_{_2}}}\) -
\(12n_{_{CO_{_2}}}\) - ![]() \(2n_{H_2O}\) = 5,28 g ⇒ n O= 0,33 mol
\(2n_{H_2O}\) = 5,28 g ⇒ n O= 0,33 mol
⇒ X có công thức đơn giản nhất là C6H11O6. Vì MX < 400 ⇒ X là C12H22O11
X có phản ứng tráng gương ⇒ X là mantozo
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Lý thuyết Tinh bột: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng
- Lý thuyết Xenlulozo: Tính chất hóa học, Tính chất vật lí, Cấu tạo, Điều chế, Ứng dụng
- Lý thuyết: Luyện tập cấu trúc và tính chất của một số Cacbohiđrat tiêu biểu
- Câu hỏi lý thuyết về tính chất của Cacbohidrat
- Các phản ứng hóa học của Glucozơ, Saccarozơ, Tinh bột, Xenlulozơ
- Nhận biết Glucozơ, Saccarozơ, Tinh bột, Xenlulozơ
- Phản ứng tráng bạc của Glucozơ
- Phản ứng thủy phân Tinh bột, Xenlulozơ
Trên đây VnDoc đã giới thiệu tới các bạn Xác định công thức phân tử Cacbohidrat. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








