Dạng bài tập phản ứng thủy phân Este
VnDoc xin giới thiệu tới bạn đọc Dạng bài tập phản ứng thủy phân Este. Chắc chắn nội dung tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 hiệu quả hơn.
Hóa học 12: Dạng bài tập phản ứng thủy phân Este
Phương pháp giải bài tập phản ứng thủy phân Este
Với este đơn chức
- Trong phản ứng thủy phân este đơn chức thì tỉ lệ là: 
Riêng phản ứng thủy phân este của phenol thì tỉ lệ là: 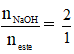
- Phản ứng thủy phân este thu được anđehit thì este phải có công thức là: RCOOCH=CH–R’.
Ví dụ: CH3COOCH=CH2 + NaOH → CH3COONa + CH3CHO
- Phản ứng thủy phân este thu được xeton thì este phải có công thức là RCOOC(R’’)=CH–R’
Ví dụ: HCOOC(CH3)=CH2 + NaOH → HCOONa + CH3-CO-CH3
(R’ có thể là nguyên tử H hoặc gốc hiđrocacbon, R’’ phải là gốc hiđrocacbon).
- Este có thể tham gia phản ứng tráng gương thì phải có công thức là HCOOR
- Este sau khi thủy phân cho sản phẩm có khả năng tham gia phản ứng tráng gương thì phải có công thức là HCOOR hoặc RCOOCH=CH–R’.
+ Nếu  ⇒ este của axit fomic: HCOOR’ hoặc este thủy phân cho andehit: RCOOCH=CH–R’
⇒ este của axit fomic: HCOOR’ hoặc este thủy phân cho andehit: RCOOCH=CH–R’
+ Nếu 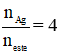 ⇒ dung dịch sau phản ứng có 2 sản phẩm đều tráng gương: HCOOCH=CH–R’
⇒ dung dịch sau phản ứng có 2 sản phẩm đều tráng gương: HCOOCH=CH–R’
- Thủy phân este đơn chức ⇒ 2 muối + nước thì đó là este của phenol:
RCOO-C6H4-R’
Ví dụ: HCOO-C6H4-CH3 + 2NaOH → HCOONa + CH3-C6H4ONa + H2O
- Nếu thủy phân este trong môi trường kiềm mà đề bài cho biết: “… Sau khi thủy phân hoàn toàn este, cô cạn dung dịch được m gam chất rắn” thì trong chất rắn thường có cả NaOH hoặc KOH dư.
mCR = mmuối + mkiềm dư
Ví dụ minh họa bài tập phản ứng thủy phân Este
Ví dụ 1: Muốn thuỷ phân 5,6 gam hỗn hợp etyl axetat và etyl fomiat (etyl fomat) cần 25,96 ml NaOH 10% (D = 1,08 g/ml). Thành phần % khối lượng của etyl axetat trong hỗn hợp là:
A. 47,14%.
B. 52,16%.
C. 36,18%.
D. 50,20%.
Giải
Đặt x là số mol CH3COOC2H5 và y là số mol HCOOC2H5.

Phương trình phản ứng:
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (1)
HCOOC2H5 + NaOH → HCOONa + C2H5OH (2)
Theo giả thiết và các phản ứng ta có hệ phương trình:

⇒ x = 0,03 và y = 0,04.
⇒ ![]() \(\%m_{CH_3COOC_2H_5}\) = 47,14%.
\(\%m_{CH_3COOC_2H_5}\) = 47,14%.
Ví dụ 2: Cho m gam chất hữu cơ đơn chức X tác dụng vừa đủ với 50 gam dung dịch NaOH 8%, sau khi phản ứng hoàn toàn thu được 9,6 gam muối của một axit hữu cơ và 3,2 gam một ancol. Công thức của X là:
A. CH3COOC2H5.
B. C2H5COOCH3.
C. CH2=CHCOOCH3.
D. CH3COOCH=CH2.
Giải
Đặt công thức của X là RCOOR’.
Ta có:

⇒ MR’OH = R’+ 17 = 32 ⇒ R’= 15 (CH3–) và MRCOONa = R + 67 = 96
⇒ R = 29 (C2H5–).
Vậy công thức của X là C2H5COOCH3.
Đáp án B.
Ví dụ 3: Một este X tạo bởi axit đơn chức và ancol đơn chức có tỉ khối với He bằng 22. Khi đun nóng X với dung dịch NaOH tạo ra muối có khối lượng bằng ![]() lượng este đã phản ứng. Tên X là:
lượng este đã phản ứng. Tên X là:
A. Etyl axetat.
B. Metyl axetat.
C. Iso-propyl fomat.
D. Metyl propionat.
Giải
Este có công thức dạng RCOOR’, muối tạo thành là RCOONa.
Phương trình phản ứng:
RCOOR’ + NaOH → RCOONa + R’OH
Vì số mol este bằng số mol muối, nên tỉ lệ về khối lượng của chúng cũng là tỉ lệ về khối lượng mol.
⇒  ⇒ 17R’ - 5R = 726 (1).
⇒ 17R’ - 5R = 726 (1).
Mặt khác Meste = 4.22 = 88 R + 44 + R’ = 88 ⇒ R + R’ = 44 (2).
Từ (1) và (2) ta có: R = 1 (H-); R’ = 43 (C3H7-).
Vậy tên este là iso-propyl fomat
Ví dụ 4: Xà phòng hóa 8,8 gam etyl axetat bằng 200 ml dung dịch NaOH 0,2M. Sau khi phản ứng xảy ra hoàn toàn, cô cạn dung dịch sau phản ứng thu được bao nhiêu gam muối khan?
Giải
Ta có: ![]() \(n_{CH_3COOC_2H_5}\)=
\(n_{CH_3COOC_2H_5}\)= ![]() = 0,1 mol
= 0,1 mol
nNaOH ban đầu = 0,2.0,2 = 0,04 mol
⇒ Este dư, NaOH hết
CH3COOC2H5 + NaOH → CH3COONa + C2H5OH (1)
Từ (1) ⇒ ![]() \(n_{CH_3COONa}\) = nNaOH = 0,04 mol
\(n_{CH_3COONa}\) = nNaOH = 0,04 mol
⇒ ![]() \(m_{CH_3COONa}\) = 0,04 . 82 = 3,28
\(m_{CH_3COONa}\) = 0,04 . 82 = 3,28
Bài tập phản ứng thủy phân Este
Câu 1. Để xà phòng hóa 17,4 gam một este no đơn chức cần dùng 300 ml dung dịch NaOH 0,5M. tìm công thức phân tử của este đem dùng.
A. C6H12O2
C. C4H8O2
B. C5H10O2
D. C6H10O2
Gọi công thức của este no, đơn chức là CnH2nO2
Khi xà phòng hóa thì: neste = nNaOH
⇒ neste = 0,3 . 0,5 = 0,15 mol ⇒ Meste = 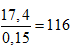
⇒ 14n + 32 =116 ⇒ n = 6
Vậy công thức phân tử của este là C6H12O2
Câu 2. Thủy phân hoàn toàn 8,8 gam este đơn chức, mạch hở X với 100 ml dung dịch KOH 1M (vừa đủ) thu được 4,6 gam một ancol Y. Xác định tên gọi của X.
A. CH3COOCH3
B. HCOOC2H5
C. CH3COOC2H5
D. C2H5COOC2H5
Gọi công thức este đơn chức X là RCOOR’
Ta có: nKOH = 0,1.1 = 0,1 mol
RCOOR’ + KOH → RCOOK + R’OH (1)
Từ (1) ⇒ nR’OH = 0,1 mol ⇒ MR’OH = ![]() = 46 g/mol
= 46 g/mol
⇒ R’= 29 ⇒ C2H5-
⇒ Y: C2H5OH
Vì MX = 88 ⇒ X là CH3COOC2H5: etyl axetat
Câu 3. E là este của một axit đơn chức và ancol đơn chức. Để thủy phân hoàn toàn 6,6 gam chất E phải dùng 34,1 ml dung dịch NaOH 10% (d = 1,1 g/ml). Lượng NaOH này dùng dư 25% so với lượng NaOH phản ứng. Công thức cấu tạo đúng của E là:
A. CH3COOCH3
B. HCOOC3H7
C. CH3COOC2H5
D. Cả B và C đều đúng
Ta có: mNaOH đem dùng = ![]() = 3,751 (gam)
= 3,751 (gam)
mNaOH phản ứng = ![]() = 3 (gam)
= 3 (gam)
⇒ ME = 88 gam ⇒ R + 44 + R’ = 88 ⇒ R + R’ = 44
- Khi R = 1 ⇒ R’ = 43 (C3H7) ⇒ CTCT (E): HCOOC3H7(propyl fomiat)
- Khi R = 15 ⇒ R’ = 29 ⇒ CTCT (E): CH3COOC2H5 (etyl axetat)
Câu 4. Để xà phòng hóa 17,4 gam một este no đơn chức cần dùng 300 ml dung dịch NaOH 0,5M. Công thức phân tử của este là:
A. C3H6O2
B. C5H10O2
C. C6H12O2
D. C4H10O2
Gọi công thức của este no, đơn chức là CnH2nO2
⇒ neste = nNaOH
⇒ neste = 0,3 . 0,5 = 0,15 (mol) ⇒ Meste = ![]() = 116
= 116
⇒ 14n + 32 = 116 ⇒ n = 6
Vậy công thức phân tử của este là C6H12O2.
Câu 5. Xà phòng hoá 22,2 gam hỗn hợp gồm 2 este đồng phân, cần dùng 12 gam NaOH, thu 20,492 gam muối khan (hao hụt 6%). Trong X chắc chắn có một este với công thức và số mol tương ứng là:
A. HCOOC2H5 0,2 mol
B. CH3COOCH3 0,2 mol.
C. HCOOC2H5 0,15 mol
D. CH3COOC2H3 0,15 mol
nEste = nNaOH = 0,3 mol; mmuối theo lí thuyết = ![]() gam.
gam.
⇒ Meste = ![]() gam/mol ⇒ công thức phân tử của 2 este có dạng C3H6O2. Vậy công thức cấu tạo của hai este là HCOOC2H5 và CH3COOCH3.
gam/mol ⇒ công thức phân tử của 2 este có dạng C3H6O2. Vậy công thức cấu tạo của hai este là HCOOC2H5 và CH3COOCH3.
Gọi x là mol của HCOOC2H5 và y là số mol của CH3COOCH3. Ta có hệ

Câu 6. Đun nóng 66,3 gam etyl propionat với 400 ml dung dịch NaOH 2M, cô cạn dung dịch sau phản ứng khối lượng chất rắn thu được là:
A. 62,4 gam.
B. 59,3 gam
C. 82,45 gam.
D. 68,4 gam.
Đáp án
Bảo toàn khối lượng ⇒ Chất rắn = 66,3 + 0,8.40 - 0,65.46 = 68,4 g
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:- Bài toán về chất béo
- Hiệu suất phản ứng Este hóa
- 30 bài tập Este trong đề thi Đại học
- 30 câu hỏi trắc nghiệm lý thuyết Este có đáp án
- Dạng bài tập cách gọi tên Este
- Dạng bài tập các phản ứng hóa học của Este
- Dạng bài tập cách nhận biết Este
- Dạng bài tập phản ứng đốt cháy Este
Trên đây VnDoc đã giới thiệu tới các bạn Dạng bài tập phản ứng thủy phân Este. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








