Tính lưỡng tính của nhôm
Chuyên đề Hóa học 12 Tính lưỡng tính của nhôm. Nội dung tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12: Tính lưỡng tính của nhôm
1. Phương pháp và ví dụ tính lưỡng tính của nhôm
Lý thuyết và Phương pháp giải
- Cho dung dịch OH- tác dụng với dung dịch Al3+ hoặc cho H+ tác dụng với dung dịch AlO-2 (hoặc [Al(OH)4]-
a/ Cho từ từ a mol OH- vào dung dịch chứa b mol Al3+. Tìm khối lượng kết tủa:
Al3+ + OH- → Al(OH)3↓
Nếu OH- dư: Al(OH)3 + OH- → AlO-2 + 2H2O
- Khi đó tùy theo tỉ lệ số mol OH-: số mol Al3+ mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
* Để giải nhanh có thể sử dụng công thức:
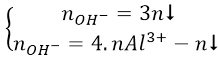
b/ Nếu cho từ từ H+ vào dung dịch chứa AlO-2 (hoặc [Al(OH)4]- thì có các phản ứng sau:
AlO-2 + H+ + H2O → Al(OH)3
Nếu H+ dư: Al(OH)3 + H+ → Al3+ + 3H2O
Khi đó tùy theo tỉ lệ số mol H3+ : số mol AlO-2 mà có kết tủa hoặc không có kết tủa hoặc vừa có kết tủa vừa có muối tan.
* Để giải nhanh có thể sử dụng công thức:
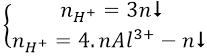
Ví dụ minh họa
Bài 1: Rót 100 ml dung dịch NaOH 3,5M vào 100 ml dung dịch AlCl3 1M thu được m gam kết tủa. Tính m?
Hướng dẫn:
Ta có: nNaOH = 0,35 mol, nAlCl3 = 0,1 mol
Vận dụng tỉ lệ T
nOH- = 0,35 mol, nAl3+ = 0,1 mol
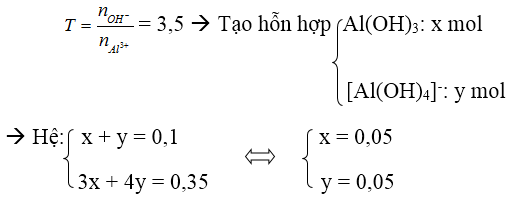
→ m↓ = 0,05 . 78 = 3,9 g
hoặc T = 3,5 nên 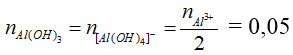
Bài 2: Cho 450 ml dung dịch KOH 2M tác dụng với 100 ml dung dịch Al2(SO4)3 1M được dung dịch X. Tính nồng độ mol/l các chất trong dung dịch X?
Hướng dẫn:
nOH- = 0,9 mol, nAl3+ = 0,2 mol
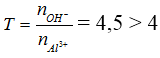
→ Tạo [Al(OH)4]- và OH- dư
Dung dịch X có![]()
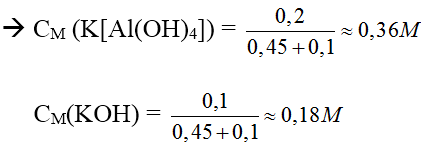
Bài 3: Cho m gam hỗn hợp bột Al và Fe tác dụng với dung dịch NaOH dư thấy thoát ra 6,72 lít khí (đktc). Nếu cho m gam hỗn hợp trên tác dụng với dung dịch HCl dư thì thấy thoát ra 8,96 lít khí (đktc). Tính khối lượng của Al và Fe trong hỗn hợp ban đầu.
Hướng dẫn:
Ta có: nH2(1) = 6,72/22,4 = 0,3(mol)
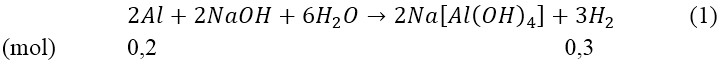
Từ (1) ⇒ nAl = 0,2(mol) ⇒ mAl = 0,2*27 = 5,4 (gam)
Mà nH2(2)(3) = 8,96/22,4 = 0,4(mol)
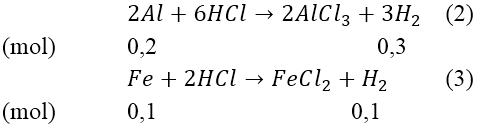
Từ (2) và (3) suy ra: mFe = 0,1*56 = 5,6(gam)
b) Bài toán ngược
Đặc điểm: Biết số mol của 1 trong 2 chất tham gia phản ứng và số mol kết tủa. Yêu cầu tính số mol của chất tham gia phản ứng còn lại.
* Kiểu 1: Biết số mol Al(OH)3, số mol Al3+. Tính lượng OH-.
Phương pháp:
- Nếu số mol Al(OH)3 = số mol Al3+: cả 2 chất phản ứng vừa đủ với nhau tạo Al(OH)3. Khi đó:
- Nếu nAl(OH)3 < nAl3+ thì có 2 trường hợp:
+) Chưa có hiện tượng hòa tan kết tủa hay Al3+ còn dư. Khi đó sản phẩm chỉ có Al(OH)3
+) Có hiện tượng hòa tan kết tủa hay Al3+ hết. Khi đó sản phẩm có Al(OH)3 và [Al(OH)4]-:
Ta có:
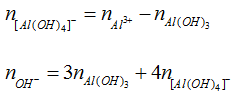
Ví dụ minh họa
Bài 1: Cho 0,5 lít dung dịch NaOH tác dụng với 300ml dung dịch Al2(SO4)3 0,2M thu được 1,56g kết tủa. Tính nồng độ mol/lít của dung dịch NaOH. Biết các phản ứng xảy ra hoàn toàn.
Hướng dẫn:
Số mol Al3+ = 0,12 mol.
Số mol Al(OH)2 = 0,02 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,02 = 0,06 mol.
→ CM(NaOH) = 0,12M
+ TH2: Al3+ hết → tạo
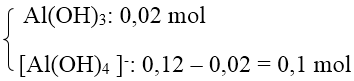
→ Số mol OH- = 3 . 0,02 + 4 . 0,1 = 0,46 mol
→ CM(NaOH) = 0,92M
* Kiểu 2: Biết số mol OH-, số mol kết tủa Al(OH)3. Tính số mol Al3+.
Phương pháp: mol OH- của bài cho với số mol OH- trong kết tủa.
+ Nếu số mol OH- của bài cho lớn hơn số mol OH- trong kết tủa thì đã có hiện tượng hoà tan kết tủa.
Sản phẩm của bài có Al(OH)3 và [Al(OH)4]-
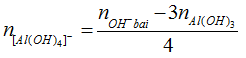 (Áp dụng bảo toàn nhóm OH-)
(Áp dụng bảo toàn nhóm OH-)
![]()
+ Nếu trong bài có nhiều lần thêm OH- liên tiếp thì bỏ qua các giai đoạn trung gian, ta chỉ tính tổng số mol OH- qua các lần thêm vào rồi so sánh với lượng OH- trong kết tủa thu được ở lần cuối cùng của bài.
Ví dụ minh họa
Bài 2: Thêm 0,6 mol NaOH vào dd chứa x mol AlCl3 thu được 0,2 mol Al(OH)3. Thêm tiếp 0,9 mol NaOH thấy số mol của Al(OH)3 là 0,5. Thêm tiếp 1,2 mol NaOH nữa thấy số mol Al(OH)3 vẫn là 0,5 mol. Tính x?
Hướng dẫn:
![]()
nAl(OH)3 = 0,5
Số mol OH- trong kết tủa là 1,5 mol < 2,7 mol → có tạo [Al(OH)4]-
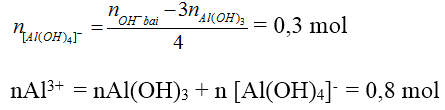
* Kiểu 3: Nếu cho cùng một lượng Al3+ tác dụng với lượng OH- khác nhau mà lượng kết tủa không thay đổi hoặc thay đổi không tương ứng với sự thay đổi OH-, chẳng hạn như:
TN1: a mol Al3+ tác dụng với b mol OH- tạo x mol kết tủa.
TN2: a mol Al3+ tác dụng với 3b mol OH- tạo x mol kết tủa hoặc 2x mol kết tủa.
Khi đó, ta kết luận:
TN1: Al3+ còn dư và OH- hết. nAl(OH)3 = nOH-/3 = x.
TN2: Cả Al3+ và OH- đều hết và đã có hiện tượng hoà tan kết tủa.
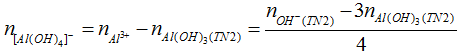
Ví dụ minh họa
Bài 3: TN1: Cho a mol Al2(SO4)3 tác dụng với 500ml dung dịch NaOH 1,2M được m gam kết tủa.
TN2: Cũng a mol Al2(SO4)3 tác dụng với 750ml dung dịch NaOH 1,2M thu được m gam kết tủa. Tính a và m?
Hướng dẫn:
Vì lượng OH- ở 2 thí nghiệm khác nhau mà lượng kết tủa không thay đổi nên:
TN1: Al3+ dư, OH- hết.
Số mol OH- = 0,6 mol → nAl(OH)3 = nOH-/3 = 0,2 mol → m = 15,6 g
TN2: Al3+ và OH- đều hết và có hiện tượng hoà tan kết tủa.
Số mol OH- = 0,9 mol → Tạo 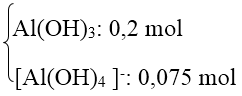
![]()
Số mol Al2(SO4)3 = 0,1375 mol = a.
2. Bài tập trắc nghiệm tính lưỡng tính của nhôm
Bài 1: Cho V lít dung dịch NaOH 0,4M tác dụng với 58,14g Al2(SO4)3 thu được 23,4g kết tủa. Tìm giá trị lớn nhất của V?
A. 2,65l
B. 2,24l
C. 1,12l
D. 3,2 l
Đáp án: A
Số mol Al3+ = 0,34 mol.
Số mol Al(OH)3 = 0,3 mol < số mol Al3+ nên có 2 trường hợp xảy ra.
+ TH1: Al3+ dư → Chỉ tạo Al(OH)3 nên số mol OH- = 3 . 0,3 = 0,9 mol.
→ V(dd NaOH) = 2,25 lít = Vmin
+ TH2: Al3+ hết → tạo 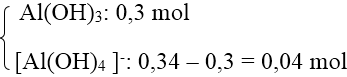
→ Số mol OH- = 3 . 0,3 + 4 . 0,04 = 1,06 mol
→ V(dd NaOH) = 2,65 lít = Vmax.
Bài 2: Cho 150 cm3 dung dịch NaOH 7M tác dụng với 100cm3 dung dịch Al2(SO4)3 1M. Hãy xác định nồng độ mol của NaOH trong dung dịch sau phản ứng.
A. 0,8M
B. 1,2M
C. 1M
D. 0,75M
Đáp án: C
Ta có: nNaOH = 7.0,15 = 1,05 mol; nAl2(SO4)3 = 1.0,1 = 0,1 mol
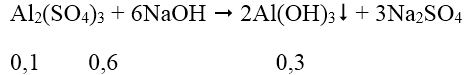
Vì NaOH dư nên:
Al(OH)3 + NaOH → Na[Al(OH)4]
Sau phản ứng có 0,2 mol Na[Al(OH)4] và 0,25 mol NaOH dư.
Nồng độ mol của Na[Al(OH)4] = 0,2/(0,15 + 0,1) = 0,8M
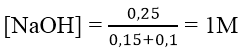
Bài 3: Cho từ từ 0,7 mol NaOH vào dung dịch chứa 0,1 mol Al2(SO4)3. Số mol kết tủa thu được là:
A. 0,2
B. 0,15
C. 0,1
D. 0,05
Đáp án: C
Ta có: nOH- = nNaOH = 0,7 mol
nAl3+ = 2.0,1 = 0,2 mol
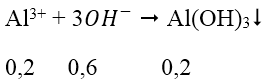
→ nOH- dư = 0,7 - 0,6 = 0,1 mol
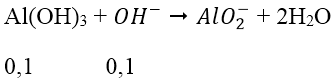
→ nAl(OH)3 còn = 0,2 - 0,1 = 0,1 mol
Bài 4: Cho 100ml dung dịch AlCl3 1M tác dụng với 200ml dung dịch NaOH. Kết tủa tạo thành được làm khô và nung đến khối lượng không đổi cân nặng 2,55g. Tính nồng độ dung dịch NaOH ban đầu.
A. 0,75 M
B. 1,75M
C. 1M
D. 1,25M
Đáp án: B
Số mol AlCl3 là nAlCl3 = 0,1.1 = 0,1 (mol)Số mol Al2O3 là nAl2O3 = 2,55/102 = 0,025 (mol)
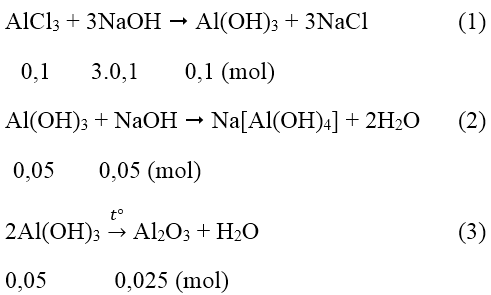
Theo pt (3) ta thấy số mol Al(OH)3 còn lại là 0,05 mol
Như vậy đã có: 0,1 - 0,05 = 0,05 mol Al(OH)3 đã bị hòa tan.
Từ (1) và (2) số mol NaOH = 3.0,1 + 0,05 = 0,35 (mol)
Nồng độ mol/l CM(NaOH) = 0,35/0,2 = 1,75M
Bài 5: Cho V lít dung dịch Ba(OH)2 0,5M vào 200 ml dung dịch Al(NO3)3 0,75M thu được 7,8 g kết tủa. Vậy V có giá trị là:
A. 0,3 và 0,6
B. 0,3 và 0,7
C. 0,4 và 0,8
D. 0,3 và 0,5
Đáp án: D
nBa(OH)2 = 0,5V → nOH- = 1V (mol)
nAl3+ = nAl(NO3)3 = 0,75.0,2 = 0,15 (mol)
nAl(OH)3 = 7,8/78 = 0,1 mol
Trường hợp 1: lượng OH- chỉ đủ tạo 0,1 mol kết tủa:
nOH- = 3.nAl(OH)3 = 0,3 mol
V = 0,3 (l)
Trường hợp 2: lượng OH- dư, hòa tan một phần kết tủa
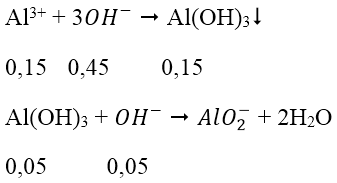
* Cách khác áp dụng nhanh công thức cho 2 trường hợp:
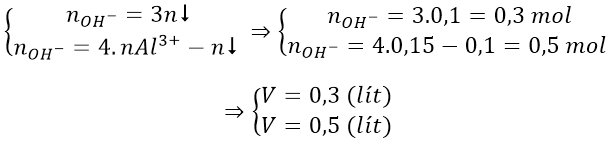
Bài 6: Hòa tan hết 0,81 gam bột nhôm vào 550ml dung dịch HCl 0,2M thu được dung dịch A. Tính thể tích dung dịch NaOH 0,5M cần thêm vào dung dịch A để thu được lượng kết tủa lớn nhất.
A. 0,22l
B. 0.2l
C. 0,15l
D. 0,12l
Đáp án: A
Số mol Al = 0,81/27 = 0,03 (mol); số mol HCl = 0,55.0,2 = 0,11 (mol)
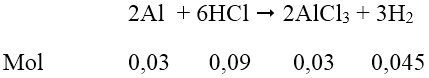
Dung dịch A thu được gồm AlCl3 = 0,03 mol; HCl = 0,11 - 0,09 = 0,02 mol.
Để có lượng kết tủa lớn nhất:
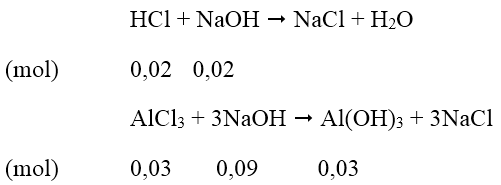
Thể tích dung dịch NaOH cần dùng = (0,02+0,09)/0,5 = 0,22 (lít)
Bài 7: Cho 200ml dung dịch AlCl3 1,5M tác dụng với V lít dung dịch NaOH 0,5M; lượng kết tủa thu được là 15,6 gam. Giá trị lớn nhất của V là:
A. 1,2
B. 1,8
C. 2,4
D. 2
Đáp án: D
Ta có: nAlCl3 = 1,5.0,2 = 0,3 mol; nAl(OH)3 = 15,6/78 = 0,2 mol
Thể tích NaOH lớn nhất khi kết tủa sinh ra cực đại, bị NaOH hòa tan 1 phần còn 15,6 (g).
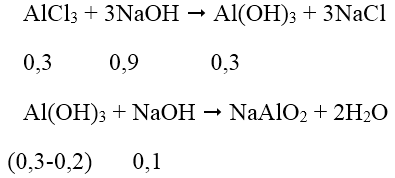
Theo phương trình phản ứng, ta có: nNaOH = 0,9 + 0,1 = 1 mol
→ VNaOH = 1/0,5 = 2 lít
Bài 8: Cho hỗn hợp gồm Na và Al có tỉ lệ mol tương ứng là 1 : 2 vào nước dư. Sau khi các phản ứng xảy ra hoàn toàn, thu được 8,96 lít khí H2 (đktc) và m gam chất rắn không tan. Giá trị của m là:
A. 10,8
B. 5,4
C. 7,8
D. 43,2
Đáp án: B
Ta có: nH2 = 0,896/22,4 = 0,04 mol
Gọi: nAl = x mol → nAl = 2x mol
Phản ứng:
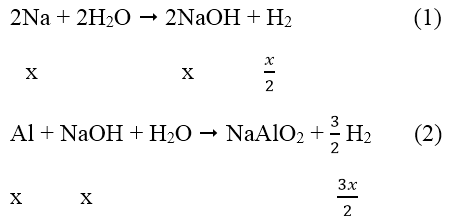
Sau các phản ứng còn m(g) chất rắn không tan, đó là khối lượng của Al dư.
Theo phản ứng (1), (2) ![]()
→ mAl ban đầu = 2x = 0,2.2 = 0,4 mol
Mà: nAl phản ứng = nNaOH = x = 0,2 mol → nAl dư = 0,4 - 0,2 = 0,2 mol
→ mAl = 0,2.27 = 5,4 (g)
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Lý thuyết: Một số hợp chất quan trọng của nhôm
- Lý thuyết: Luyện tập tính chất của nhôm và hợp chất của nhôm
- Tính chất chung của kim loại kiềm, kiềm thổ, nhôm
- Chuỗi phản ứng hóa học của kim loại kiềm, kiềm thổ, nhôm
- Nhận biết, điều chế kim loại kiềm, kiềm thổ, nhôm
- Bài toán xác định tên kim loại
- CO2, SO2 tác dụng với dung dịch kiềm
Trên đây VnDoc đã giới thiệu tới các bạn Tính lưỡng tính của nhôm. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








