Các bài toán về chuẩn độ acid base, chuẩn độ oxi hóa khử
VnDoc xin giới thiệu tới bạn đọc Các bài toán về chuẩn độ axit bazơ, chuẩn độ oxi hóa khử. Nội dung tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12: Các bài toán về chuẩn độ axit bazơ, chuẩn độ oxi hóa khử
1. Phương pháp và ví dụ các bài toán về chuẩn độ axit bazơ, chuẩn độ oxi hóa khử
Lý thuyết và Phương pháp giải
a. Phương pháp chuẩn độ trung hòa (chuẩn độ axit - bazơ)
- Dùng những dung dịch kiềm (NaOH hoặc KOH) đã biết chính xác nồng độ làm dung dịch chuẩn để chuẩn độ các dung dịch axit và dùng các dung dịch axit mạnh (HCl, HNO3, H2SO4) đã biết chính xác nồng độ làm dung dịch chuẩn để độ các dung dịch bazơ.
- Để nhận ra điểm tương đương (thời điểm dung dịch chuẩn vừa phản ứng hết với dung dịch cần xác định) của phản ứng chuẩn độ trung hòa, người ta dùng chất chỉ thị axit - bazơ (hay chỉ thi pH, là những axit yếu có màu sắc thay đổi theo pH).
Bảng ghi khoảng pH đổi màu của một số chỉ thị
| Tên thông dụng của chất chỉ thị | Khoảng pH đổi màu | Màu dạng axit - bazơ |
| Metyl da cam | 3,1 - 4,4 | Đỏ - vàng |
| Metyl đỏ | 4,2 - 6,3 | Đỏ - vàng |
| Phenolphtalein | 8,3 - 10,0 | Không màu - đỏ |
Với mỗi phản ứng chuẩn độ cụ thể người ta chọn những chất chỉ thị nào có khoảng đổi màu trắng hoặc rất sát điểm tương đương.
b. Chuẩn độ oxi hóa khử bằng phương pháp pemangant
- Chuẩn độ oxi hóa - khử (phương pháp pemangant): được dùng để chuẩn độ dung dịch của các chất khử (Ví dụ: Fe2+, H2O2, H2C2O4, .. ) trong môi trường axit mạnh (thường dùng dung dịch H2SO4 loãng), khi đó MnO4- bị khử về Mn2+ không màu:
MnO4- + 8H+ + 5e → Mn2+ + 4H2O
- Trong phương pháp này chất chỉ thị chính là KMnO4 vì ion Mn2+ không màu do đó khi dư một giọt KMnO4 dung dịch từ không màu chuyển sang màu hồng rất rõ giúp ta kết thúc chuẩn độ.
Ví dụ minh họa
Bài 1: Cần thêm vào bao nhiêu ml dung dịch NaOH 0,25M vào 50 ml dug dịch hỗn hợp HCl 0,1M và H2SO4 0,05M để thu được dung dịch có pH = 2?
Hướng dẫn:
nNaOH = nOH = 0,25.V (mol)
nH+ = nHCl + 2nH2SO4 = 0,05.0,1 + 0,05.2.0,05
pH = 2 ⇒ [H+] = 10 - 2 M = 0,01 mol
Ta có: (0,01 - 0,25V)/(0,05 + V) = 10 - 2
0,01 - 0,25.V = 0,01.0,05 + 0,01 V ⇒ 0,26.V = 0,01 - 0,01.0,05
V = 0,0365 l = 36,5 ml
Bài 2: Lấy 25ml dung dịch A gồm FeSO4 và Fe2(SO4)3 rồi chuẩn độ bằng dung dịch hỗn hợp KMnO4 0,025M thì hết 18,10ml. Mặt khác, thêm lượng dư dung dịch NH3 vào 25ml dung dịch A thì thu được kết tủa, lọc kết tủa rồi nung đỏ trong không khí ở nhiệt độ cao đến khối lượng không đổi, cân được 1,2g. Nồng độ mol/l của FeSO4 và Fe2(SO4)3 lần lượt là:
A. 0,091 và 0,25
B. 0,091 và 0,265
C. 0,091 và 0,255
D. 0,087 và 0,255
Hướng dẫn:
Ta có:
nFeSO4 = 5.nKMnO4 = 2,2615.10-3 mol
CMFeSO4 = 2,2625/0,025 = 0,091M
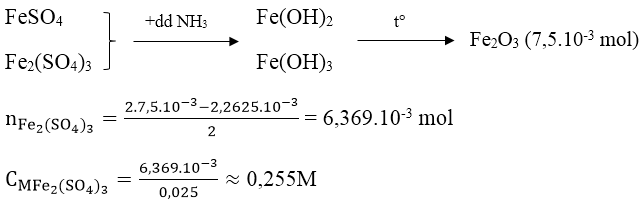
2. Bài tập trắc nghiệm các bài toán về chuẩn độ axit bazơ, chuẩn độ oxi hóa khử
Bài 1: Để xác định nồng đội dung dịch NaOH người ta tiến hành như sau: cân 1,26 gam axit oxalic ngậm nước (H2C2O4.2H2O) hòa tan hoàn toàn vào nước, định mức thành 100 ml. lấy 10 ml dung dịch này thêm vào đó vài giọt phenolphthalein, đem chuẩn độ bằng dung dịch NaOH đến xuất hiện màu hồng (ở pH = 9) thì hết 17,5 ml dung dịch NaOH. Tính nồng độ dung dịch NaOH đã dùng.
A. 0,114M
B. 0,26M
C. 0,124M
D. 0,16M
Đáp án: A
Chuẩn độ: H2C2O4 + 2NaOH → Na2C2O4 + 2H2O
Nồng độ dung dịch H2C2O4: C_(H2C2O4) = 1,26/126.1000/100 = 0,1M
Theo phản ứng: nNaOH = 2nH2C2O4.V = 2.10-3 mol
⇒ CM(NaOH) = 0,114M
Bài 2: Chuẩn độ 20 ml dung dịch hỗn hợp HCl 0,1M + HNO3 a mol/l cần dùng hết 16,5 ml dung dịch hỗn hợp KOH 0,1M và Ba(OH)2 0,05M. Giá trị của a là:
A. 0,07
B. 0,08
C. 0,065
D. 0,068
Đáp án: C
∑nH+ = 0,02.0,1 + 0,02a
∑nOH- = 0,0165.0,1 + 0,0165.2.0,05 = 3,3.10 - 3 mol
Trung hòa dung dịch thì ∑nH+ = ∑nOH-
0,02.0,1 + 0,02a = 3,3.10 - 3 ⇒ a = 0,065 mol/l
Bài 3: Để xác định nồng độ dung dịch H2O2, người ta hòa tan 0,5 gam nước oxi già vào nước, thêm H2SO4 tạo môi trường axit. Chuẩn độ dung dịch thu được cần vừa đủ 10 ml dung dịch KMnO4 0,1M. Xác định hàm lượng H2O2 trong nước oxi già.
A. 9%
B. 17%
C. 12%
D. 21%
Đáp án: B
Phản ứng
5H2O2 + 2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + SO2 + 8H2O
Từ phản ứng ⇒ nH2O2 = 5/2 nKMnO4 = 2,5.10-3 (mol)
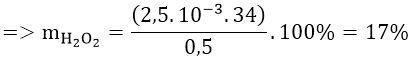
Bài 4: Để xác định hàm lượng FeCO3 trong quặng xi đe rit, người ta làm như sau: còn 0,6g mẫu quặng, chế hóa nó theo một quy trình hợp lí, thu được FeSO4 trong môi trường H2SO4 loãng. Chuẩn đọ dung dịch thu được bằng dung dịch chuẩn KMnO4 0,025M thì dùng vừa hết 25,2ml. % theo khối lượng của FeCO3 là:
A. 12,18%
B. 24,26%
C. 60,9%
D. 30,45%
Đáp án: C
nKMnO4 = 0,025.25,2/1000 = 6,3.10-4 mol
Phương trình phản ứng:
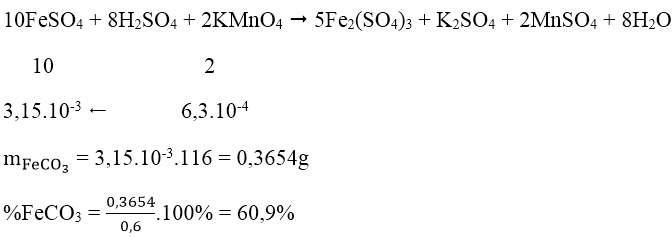
Bài 5: Chuẩn độ 20 ml dung dịch HCl chưa biết nồng độ đã dùng hết 17 ml dung dịch NaOH 0,12M. Xác định nồng độ mol của dung dịch HCl.
A. 0,102M
B. 0,12M
C. 0.08M
D. 0,112M
Đáp án: A
PTHH: HCl + NaOH → NaCl + H2O
nNaOH = 0,017.0,12 = 0,00204(mol)
Theo PT: nHCl = nNaOH = 0,00204mol
Nồng độ mol của dung dịch HCl là: 0,00204/0,02 = 0,102(M)








