Dạng bài tập phản ứng khử Este
VnDoc xin giới thiệu tới bạn đọc Dạng bài tập phản ứng khử Este. Hy vọng tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 hiệu quả hơn.
Hóa học 12: Dạng bài tập phản ứng khử Este
Phản ứng khử este bởi líti-nhôm hiđrua LiAlH4 thành ancol bậc I
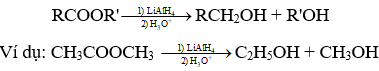
Ví dụ minh họa bài tập phản ứng khử Este
Ví dụ 1: Khử este no, đơn chức, mạch hở X bằng LiAlH4, thu được ancol duy nhất Y. Đốt cháy hoàn toàn Y thu được 0,2 mol CO2 và 0,3 mol H2O. Đốt cháy hoàn toàn 0,1 mol X thu được tổng khối lượng CO2 và H2O là:
A. 24,8 gam
B. 28,4 gam
C. 16,8 gam
D. 18,6 gam
Giải
Khử este no, đơn chức, mạch hở X bằng LiAlH4 thu được ancol duy nhất Y
⇒ X có dạng R-COO-CH2-R
R-COO-CH2-R ![]() 2RCH2OH
2RCH2OH
Đốt Y: ![]() \(n_{CO_2}\) = 0,2 mol và
\(n_{CO_2}\) = 0,2 mol và ![]() \(n_{H_2O}\) = 0,3mol ⇒ nY = 0,1mol
\(n_{H_2O}\) = 0,3mol ⇒ nY = 0,1mol
![]() Số C = = 2 ⇒ Y là C2H5OH
Số C = = 2 ⇒ Y là C2H5OH
⇒ X là CH3COOC2H5
nX = 0,1 ⇒ ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{H_2O}\) = 0,4 mol
\(n_{H_2O}\) = 0,4 mol
⇒ m = ![]() \(m_{CO_2}\)+
\(m_{CO_2}\)+ ![]() \(m_{H_2O}\) = 44.0,4 + 18.0,4 = 24,8 gam.
\(m_{H_2O}\) = 44.0,4 + 18.0,4 = 24,8 gam.
Ví dụ 2: Khử este no, đơn chức E bằng LiAlH4 thu đc 1 ancol duy nhất G. Đốt cháy m g G cần 2,4 m g O2. Đốt cháy m g E thu được tổng CO2 và H2O là 52,08g. CHo toàn bộ CO2, H2O này vào 500ml dd Ba(OH)2 1M thu được bao nhiêu gam kết tủa?
A. 25,61
B. 31,52
C. 35,46
D. 39,4
Giải
Khi đốt E có ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{H_2O}\) = 0,84 mol
\(n_{H_2O}\) = 0,84 mol
nOH- = 0,5.2 = 1 mol
CO2 + 2OH- → CO32- + H2O
CO2 + OH- → HCO3-
⇒ ![]() \(n_{CO_3^{2-}}\) = nOH- -
\(n_{CO_3^{2-}}\) = nOH- - ![]() \(n_{CO_2}\) = 1 - 0,84 = 0,16 mol
\(n_{CO_2}\) = 1 - 0,84 = 0,16 mol
⇒![]() \(m_{BaCO_3}\) = 197 . 0,16 = 31,52g
\(m_{BaCO_3}\) = 197 . 0,16 = 31,52g
Đáp án B
- 30 bài tập Este trong đề thi Đại học
- 30 câu hỏi trắc nghiệm lý thuyết Este có đáp án
- Dạng bài tập cách gọi tên Este
- Dạng bài tập các phản ứng hóa học của Este
- Dạng bài tập cách nhận biết Este
- Dạng bài tập phản ứng đốt cháy Este
- Dạng bài tập phản ứng thủy phân Este
- Bài tập phản ứng thủy phân Este đa chức
- Dạng bài tập phản ứng Este hóa
Trên đây VnDoc đã giới thiệu tới các bạn Dạng bài tập phản ứng khử Este. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








