Bài tập về hỗn hợp Este hay có đáp án
Chuyên đề Hóa học 12 Bài tập về hỗn hợp Este hay có đáp án. Hy vọng tài liệu sẽ giúp các bạn giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12: Bài tập về hỗn hợp Este hay có đáp án
Phương pháp giải bài tập về hỗn hợp Este
Khi bài cho 2 chức hữu cơ khi tác dụng với NaOH hoặc KOH tạo ra:
a) 2 muối và 1 ancol thì:
+ TH1: RCOOR’ và R”COOR’ có nNaOH = nR’OH
RCOOR’ + NaOH → RCOONa + R’OH
R”COOR’ + NaOH → R”COONa + R’OH
⇒ nNaOH = nR’OH
+ TH2: RCOOR’ và R”COOH có nNaOH > nR’OH
RCOOR’ + NaOH → RCOONa + R’OH
R”COOH + NaOH → R”COONa + H2O
⇒ nNaOH > nR’OH
b) 1 muối và 1 ancol thì:
+ TH1: RCOOR’ và R’OH
RCOOR’ + NaOH → RCOONa + R’OH
+ TH2: RCOOR’ và RCOOH
RCOOR’ + NaOH → RCOONa + R’OH
RCOOH + NaOH → RCOONa + H2O
+ TH3: RCOOH và R’OH
RCOOH + NaOH → RCOONa + H2O
c) 1 muối và 2 ancol thì:
+ TH1: RCOOR’ và RCOOR”
RCOOR’ + NaOH → RCOONa + R’OH
RCOOR” + NaOH → RCOONa + R”OH
+ TH2: RCOOR’ và R”OH
RCOOR’ + NaOH → RCOONa + R’OH
Ví dụ minh họa bài tập về hỗn hợp Este
Ví dụ 1: Hỗn hợp X gồm 1 ancol no, đơn chức và 1 axit no, đơn chức mạch hở.
Chia X thành 2 phần bằng nhau.
- Đốt cháy hoàn toàn phần 1 sản phẩm thu được cho qua bình nước vôi trong dư thấy có 30g kết tủa.
- Phần 2 được este hoá hoàn toàn vừa đủ thu được 1 este, đốt cháy este này thu được khối lượng H2O là:
A. 1,8g.
B. 3,6g.
C. 5,4g.
D. 7,2g.
Giải
Este thu được sẽ là este no, đơn chức mạch hở
Khi đốt este này thu được ![]() \(n_{H_2O}\) =
\(n_{H_2O}\) = ![]() \(n_{CO_2}\)
\(n_{CO_2}\)
Do số C không đổi trong cả 2 phần nên
![]() \(n_{H_2O}\) =
\(n_{H_2O}\) = ![]() \(n_{CO_2}\) =
\(n_{CO_2}\) = ![]() \(n_{CaCO_3}\) = 0,3 mol ⇒
\(n_{CaCO_3}\) = 0,3 mol ⇒ ![]() \(m_{H_2O}\) = 5,4 g
\(m_{H_2O}\) = 5,4 g
Ví dụ 2: Hỗn hợp X gồm 2 chất A, B mạch hở, đều chứa các nguyên tố C, H, O và đều không tác dụng Na. Cho 10,7g hh X tác dụng vừa đủ NaOH rồi cô cạn sản phẩm thu được phần rắn gồm 2 muối natri của 2 axít đơn chức no đồng đẳng liên tiếp và phần hơi bay ra chỉ có một rượu E duy nhất. Cho E tác dụng với Na dư thu được 1,12lít H2 (đktc). Oxi hoá E bằng CuO đun nóng và cho sản phẩm có thể tham gia phản ứng tráng gương.
a) Tìm CTCT của E biết dE/KK = 2
b) Tìm CTCT A, B biết MA < MB
Giải
a. ME = 29.2 = 58
Oxi hoá E bằng CuO đun nóng và cho sản phẩm có thể tham gia phản ứng tráng gương ⇒ E là ancol bậc 1.
⇒ E: C3H6O : CH2=CH-CH2OH (rượu allylic)
b. Theo bài ra A, B là 2 este đơn chức, đồng đẳng liên tiếp: RCOOC3H5
nX = nrượu = ![]() \(2n_{H_2}\) = 0,1 ⇒ MX = 10,7/0,1 = 107 ⇒ R = 22
\(2n_{H_2}\) = 0,1 ⇒ MX = 10,7/0,1 = 107 ⇒ R = 22
⇒ A: CH3COOCH2-CH=CH2 và B: C2H5COOCH2-CH=CH2
Bài tập vận dụng bài tập về hỗn hợp Este
Câu 1. X là hỗn hợp chứa một axit đơn chức, một ancol hai chức và một este hai chức (đều mạch hở). Người ta cho X qua dung dịch nước Br2 thì không thấy nước Br2 bị nhạt màu. Đốt cháy hoàn toàn 0,09 mol X cần 10,752 lít khí O2 (đktc). Sau phản ứng thấy khối lượng của CO2 lớn hơn khối lượng của H2O là 10,84 gam. Mặt khác, 0,09 mol X tác dụng vừa hết với 0,1 mol KOH. Cô cạn dung dịch sau phản ứng thu được m gam muối khan và một ancol có 3 nguyên tử C trong phân tử. Giá trị của m là:
A. 9,8
B. 8,6
C. 10,4
D. 12,6
![]() \(n_{O_2}\) = 0,48 mol
\(n_{O_2}\) = 0,48 mol
Do chỉ thu được 1 ancol có 3 nguyên tử C ⇒ Ancol đó là C3H6(OH)2
Este = Axit + Ancol – H2O nên ta quy đổi hỗn hợp X thành:
axit CnH2nO2: 0,1 mol
ancol C3H6 (OH)2: a mol
H2O: -b mol
⇒ nX = 0,1 + a – b = 0,09 (1)
PTHH:
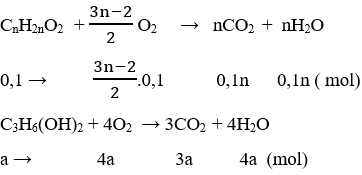
Ta có hệ pt:
![]() \(n_{O_2}\) = 0,05.(3n-2)+ 4a = 0,48 (2)
\(n_{O_2}\) = 0,05.(3n-2)+ 4a = 0,48 (2)
![]() \(m_{CO_2}\) –
\(m_{CO_2}\) – ![]() \(m_{H_2O}\) = 44.(0,1n + 3a) – 18.(0,1n + 4a – b) = 10,84 (3)
\(m_{H_2O}\) = 44.(0,1n + 3a) – 18.(0,1n + 4a – b) = 10,84 (3)
Từ (1), (2), (3) ⇒ a = 0,07 ; b = 0,08 ; n = 2
Mặt khác
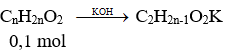
Với n = 2 ⇒ mmuối = 0,1. 98 = 9,8 gam
Câu 2. Hỗn hợp X chứa ba este mạch hở; trong đó có hai este đơn chức và một este hai chức, không no. Đốt cháy hoàn toàn 29,04 gam X cần dùng 1,59 mol O2, thu được 20,52 gam nước. Mặt khác hiđro hóa hoàn toàn 29,04 gam X với lượng H2 vừa đủ (xúc tác Ni, to) thu được hỗn hợp Y. Đun nóng toàn bộ Y với dung dịch NaOH vừa đủ, thu được hỗn hợp Z chứa hai ancol và hỗn hợp T chứa hai muối của hai axit kế tiếp trong dãy đồng đẳng. Dẫn toàn bộ Z qua bình đựng Na dư, thấy khối lượng bình tăng 13,41 gam. Nung nóng hoàn toàn T với vôi tôi xút thu được hỗn hợp khí có khối lượng là 6,96 gam. Phần trăm khối lượng của este có khối lượng phân tử lớn nhất trong hỗn hợp X là:
A. 57,0%.
B. 53,3%.
C. 48,9%.
D. 49,6%.
![]() \(n_{H_2O}\) = 0,57mol. Bảo toàn khối lượng ⇒
\(n_{H_2O}\) = 0,57mol. Bảo toàn khối lượng ⇒ ![]() \(n_{CO_2}\) = 0,675mol
\(n_{CO_2}\) = 0,675mol
Bảo toàn O ⇒ nO(X) = 0,33mol
⇒ Đốt 29,04 gam X ⇒ ![]() \(n_{CO_2}\) = 1,35 và
\(n_{CO_2}\) = 1,35 và ![]() \(n_{H_2O}\) = 1,14mol
\(n_{H_2O}\) = 1,14mol
nO(Y) = 0,66 ⇒ nNaOH = 0,33mol
RCOONa + NaOH → RH + Na2CO3
0,33mol
⇒ R + 1 = 6,96/0,33 ⇒ R = 20,09 ⇒ 2 muối là CH3COONa và C2H5COONa
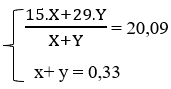
⇒![]() \(n_{CH_3COONa}\) = 0,21 mol và
\(n_{CH_3COONa}\) = 0,21 mol và ![]() \(n_{C_2H_5COONa}\) 0,12 mol
\(n_{C_2H_5COONa}\) 0,12 mol
nOH- (Z) = 0,33 mol ⇒ ![]() \(n_{H_2}\) = 0,165mol
\(n_{H_2}\) = 0,165mol
mZ = mtăng + ![]() \(m_{H_2}\) = 13,74g
\(m_{H_2}\) = 13,74g
Bảo toàn khối lượng ⇒ mY = 29,28g
⇒ ![]() \(n_{H_2}\) phản ứng =
\(n_{H_2}\) phản ứng = ![]() = 0,12 mol
= 0,12 mol
⇒ Đốt Y ⇒ ![]() \(n_{CO_2}\) = 1,35 mol và
\(n_{CO_2}\) = 1,35 mol và ![]() \(n_{H_2O}\)O = 1,14 + 0,12 = 1,26 mol
\(n_{H_2O}\)O = 1,14 + 0,12 = 1,26 mol
⇒ nEste đôi = ![]() \(n_{CO_2}\) –
\(n_{CO_2}\) – ![]() \(n_{H_2O}\) = 0,09mol
\(n_{H_2O}\) = 0,09mol
Bảo toàn O ⇒ nEste đơn = 0,15mol
⇒ nAncol đơn (0,15mol) và nAncol đôi (0,09mol), với Z1 và Z2 là phân tử khối tương ứng.
mZ = 0,15Z1 + 0,09Z2 = 13,74
⇒ 5Z1 + 3Z2 = 458
⇒ Z1 = 46 và Z2 = 76 là nghiệm duy nhất.
⇒ Z gồm C2H5OH (0,15mol) và C3H6(OH)2 (0,09mol)
Kết hợp với số mol muối ta có Y chứa:
CH3COOC2H5 (0,12mol); C2H5COOC2H5 (0,03mol) và CH3COO-C3H6-OOC-C2H5(0,09mol)
Trong phản ứng cộng H2, dễ thấy nH2 = nC2H5COONa nên X chứa:
CH3COOC2H5 (0,12mol); C2H3COOC2H5 (0,03mol) và CH3COO-C3H6-OOC-C2H3(0,09mol)
⇒ %CH3COO-C3H6 -OOC-C2H3 = 53,3%
Câu 3. Hỗn hợp A gồm axit axetic và etanol. Chia A thành ba phần bằng nhau.
+ Phần 1 tác dụng với Kali dư thấy có 3,36 lít khí thoát ra.
+ Phần 2 tác dụng với Na2CO3 dư thấy có 1,12 lít khí CO2 thoát ra. Các thể tích khí đo ở đktc.
+ Phần 3 được thêm vào vài giọt dung dịch H2SO4, sau đó đun sôi hỗn hợp một thời gian. Biết hiệu suất của phản ứng este hoá bằng 60%. Khối lượng este tạo thành là bao nhiêu?
A. 8,80 gam.
B. 5,20 gam.
C. 10,56 gam.
D. 5,28 gam.
![]() \(n_{CH_3COOH}\) = 3a mol,
\(n_{CH_3COOH}\) = 3a mol, ![]() \(n_{C_2H_5OH}\)= 3b mol
\(n_{C_2H_5OH}\)= 3b mol
Phần 1: ![]() \(n_{H_2}\) = 0,15 mol
\(n_{H_2}\) = 0,15 mol
⇒ Trong 1 phần: nhh A = 0,15.2 = 0,3 mol
Phần 2: ![]() \(n_{CO_2}\) = 0,05 mol
\(n_{CO_2}\) = 0,05 mol
![]() \(n_{CH_3COOH}\) = a = 0,05.2 = 0,1 mol ⇒ b = 0,3 – 0,1 = 0,2 mol
\(n_{CH_3COOH}\) = a = 0,05.2 = 0,1 mol ⇒ b = 0,3 – 0,1 = 0,2 mol
Phần 3: CH3COOH + C2H5OH → CH3COOC2H5 + H2O
![]() \(m_{CH_3COOC_2H_5}\) = 0,1. 88. 60% = 5,28g
\(m_{CH_3COOC_2H_5}\) = 0,1. 88. 60% = 5,28g
Đáp án D
Câu 4. Hỗn hợp X gồm một ancol đơn chức Y, axit hữu cơ Z và este T tạo ra từ ancol Y và axit Z. Cho m gam X tác dụng với 200 ml dung dịch KOH 0,5 M(dư 25% so với lượng phản ứng) đung nóng, sau khi kết thúc các phản ứng thu được dung dịch A. Cô cạn dung dịch A thu được 8,96 gam chất rắn khan. Đốt cháy hoàn toàn m gam X trên bằng O2 lấy dư, thu được 8,96 lít CO2 (đktc) và 10,8 gam H2O. Công thức của T là
A. HCOOC2H5
B. HCOOCH3
C. CH3COOC2H5
D. CH3COOCH3
nKOH = 0,1 mol = nKOH pư + 25% nKOH pư
⇒ nKOH pư = 0,08mol và nKOH dư = 0,02 mol
Khi cô cạn A thu được RCOOK (0,08mol); KOH dư (0,02 mol)
mrắn = 8,96g ⇒ mRCOOK = 8,96 - 0,02.56 = 7,84g
⇒ MRCOOK = 7,84/0,08 =94 = > R = 15
Vậy Z là CH3COOH
Đốt X thu ![]() \(n_{H_2O}\) = 0,6 >
\(n_{H_2O}\) = 0,6 > ![]() \(n_{CO_2}\) = 0,4 nên ancol no.
\(n_{CO_2}\) = 0,4 nên ancol no.
Vì este = axit + ancol –H2 nên quy đổi X thành:
CnH2n+2O: a mol
CH3COOH: 0,08 mol
H2O: -b mol
![]() \(n_{CO_2}\) = na + 0,16 = 0,4 (1)
\(n_{CO_2}\) = na + 0,16 = 0,4 (1)
![]() \(n_{H_2O}\) = na + a + 0,16 – b = 0,6 (2)
\(n_{H_2O}\) = na + a + 0,16 – b = 0,6 (2)
Lấy (2) – (1) ⇒ a – b = 0,2 ⇒ a > 0,2
Từ (1) ⇒ na = 0,24 ⇒ ![]() = 1,2
= 1,2
Vậy n = 1 ⇒ Ancol CH3OH và este CH3COOCH3
Câu 5. Y là hai axit đều đơn chức; Z là este thuần chức, mạch hở được tạo bởi X, Y và glixerol. Đốt cháy hoàn toàn 9,16 gam hỗn hợp E chứa X, Y, Z cần dùng 0,2 mol O2, thu được 3,24 gam nước. Mặt khác hiđro hóa hoàn toàn 9,16 gam E cần dùng 0,08 mol H2 (xúc tác Ni, to), thu được hỗn hợp T. Đun nóng toàn bộ T với 300 ml dung dịch KOH 1M, cô cạn dung dịch sau phản ứng thu được m gam rắn khan. Giá trị của m là
A. 22,68.
B. 19,72.
C. 21,94.
D. 14,40.
Bảo toàn khối lượng cho phản ứng đốt E ⇒ ![]() \(n_{CO_2}\) = 0,28mol
\(n_{CO_2}\) = 0,28mol
Bảo toàn khối lượng cho phản ứng cộng H2 ⇒ mT = 9,32g
Nếu đốt T thì cần ![]() \(n_{O_2}\) =
\(n_{O_2}\) = ![]() = 0,24 và thu được:
= 0,24 và thu được:
![]() \(n_{CO_2}\) = 0,28mol
\(n_{CO_2}\) = 0,28mol
![]() \(n_{H_2O}\) = 0,18 + 0,08 = 0,26mol
\(n_{H_2O}\) = 0,18 + 0,08 = 0,26mol
Vì este = axit + ancol – H2 ⇒ Quy đổi T thành:
CnH2nO2: a mol
C3H5(OH)3: b mol
H2O: -3b mol
![]() \(n_{CO_2}\) = na + 3b = 0,28
\(n_{CO_2}\) = na + 3b = 0,28
![]() \(n_{H_2O}\) = na + 4b – 3b = 0,26
\(n_{H_2O}\) = na + 4b – 3b = 0,26
mT = a(14n + 32) + 92b – 18.3b = 9,16 + 0,08.2
Giải hệ trên được:
a = 0,17
b = 0,01
na = 0,25 ⇒ ![]()
Chất rắn gồm CnH2n-1O2K (0,17 mol) và KOH dư (0,13 mol)
⇒ mrắn = 22,68g
- Dạng bài tập phản ứng Este hóa
- Dạng bài tập phản ứng khử Este
- Phương pháp điều chế và ứng dụng của Este
- Bài tập về Este đa chức
- Tìm công thức phân tử của Este dựa vào phản ứng đốt cháy
- Tìm công thức phân tử của Este dựa vào phản ứng xà phòng hóa
- Tìm công thức phân tử của Este dựa vào phản ứng thủy phân
- Bài tập hỗn hợp Este đơn chức tham gia phản ứng xà phòng hóa
Trên đây VnDoc đã giới thiệu tới các bạn Bài tập về hỗn hợp Este hay có đáp án. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








