Lý thuyết Nhôm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
Chuyên đề Hóa học 12 Lý thuyết Nhôm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng. Nội dung tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Hóa học 12: Lý thuyết Nhôm
I. Vị trí, cấu tạo của nhôm
- Nhôm có số hiệu nguyên tử 13, thuộc nhóm IIIA, chu kì 3.
- Cấu hình electron: 1s22s22p63s23p1, hay [Ne] 3s23p1.
- Mạng tinh thể: nhôm có cấu tạo kiểu mạng lập phương tâm diện.
II. Tính chất vật lý của nhôm
- Là kim loại nhẹ, màu trắng bạc.
- Nhôm rất dẻo, dẫn điện, dẫn nhiệt rất tốt.
III. Tính chất hóa học của nhôm
Tính khử mạnh: Al → Al3+ + 3e
1. Tác dụng với phi kim
- Với oxi: Ở to thường tạo lớp màng oxit bảo vệ. Nếu đốt bột nhôm thì sẽ phản ứng mạnh.
Ví dụ:
![]()
- Với phi kim khác:
+ Với Cl2, Br2 phản ứng ngay ở to thường tạo thành AlCl3, AlBr3 phản ứng bốc cháy.
Ví dụ:
![]()
+ Khi đun nóng, phản ứng được với I2, S. Khi đun nóng mạnh, phản ứng được với N2, C.
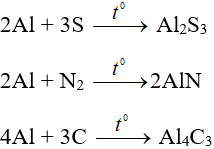
2. Tác dụng với axit
- Axit thường: khử dễ dàng ion H+ thành H2.
Al + 3HCl → AlCl3 + 3/2 H2
- Axit oxi hóa: Không tác dụng với axit H2SO4, HNO3 đặc nguội. Al tác dụng mạnh với axit HNO3 loãng, H2SO4 đặc, nóng.
Ví dụ:
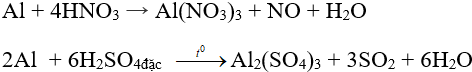
3. Tác dụng với oxit kim loại – Phản ứng nhiệt nhôm
Ở to cao, Al khử được nhiều ion kim loại trong oxit như (Fe2O3, Cr2O3, CuO …) thành kim loại tự do.
Ví dụ:
![]()
4. Tác dụng với nước
Vật bằng nhôm không tác dụng với H2O ở bất kì to nào vì có lớp oxit bảo vệ. Nếu phá bỏ lớp bảo vệ, nhôm khử được nước ở to thường, nhưng phản ứng nhanh chóng dừng lại vì tạo kết tủa Al(OH)3.
5. Tác dụng với dung dịch kiềm
Al + NaOH + 3H2O → Na[(Al(OH)4] + 3/2 H2↑
Phương trình ion thu gọn:
Al + OH- + 3H2O → [(Al(OH)4]- + 3/2 H2↑
Với chương trình cơ bản có thể viết:
Al + NaOH + H2O → NaAlO2 + 3/2 H2↑
IV. Ứng dụng, điều chế của nhôm
1. Ứng dụng
- Nhôm có nhiều ưu điểm nhưng vì nó khá mềm lại kém dai nên người ta thường chế tạo hợp kim nhôm với magie, đồng, silic... để tăng độ bền.
+ Đura (95% Al, 4%Cu, 1%Mg, Mn, Si). Hợp kim đura nhẹ bằng 1/3 thép, cứng gần như thép.
+ Silumin (∼90% Al, 10%Si): nhẹ, bền.
+ Almelec (98,5% Al. còn lại là Mg, Si, Fe) dùng làm dây cáp.
+ Hợp kim electron (10,5% Al, 83,3% Mg, còn lại là Zn, Mn...), hợp kim này chỉ nặng bằng 65% Al lại bền hơn thép, chịu được sự thay đổi đột ngột nhiệt độ trong một giới hạn lớn nên được dùng làm vỏ tên lửa.
- Nhôm được dùng chế tạo các thiết bị trao đổi nhiệt và dụng cụ nấu ăn gia đình, nhôm còn được dùng là khung cửa và trang trí nội thất.
- Bột nhôm dùng để chế tạo hỗn hợp tecmit (hỗn hợp bột Al và Fe2O3), được dùng để hàn đường ray, ...
2. Điều chế
Từ quặng boxit (Al2O3.Fe2O3.SiO2) cho tác dụng với dung dịch NaOH đặc, chất không tan là Fe2O3.
Al2O3 + 2NaOH + 3H2O → Na[(Al(OH)4]
SiO2 + 2NaOH → Na2SiO2 + H2O
Sục CO2 dư vào hỗn hợp dung dịch Al(OH)3 kết tủa trở lại:
Na[(Al(OH)4] + CO2 → Al(OH)3 + NaHCO3
Lọc kết tủa, nung đến khối lượng không đổi:
![]()
Điện phân nóng chảy nhôm oxit và hỗn hợp cryolit (N) ở 900oC.
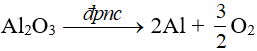
Vai trò của cryolit:
Giảm nhiệt độ nóng chảy của Al2O3.
Tăng khả năng dẫn điện của dung dịch điện phân.
Tạo lớp xỉ trên bề mặt, ngăn cản quá trình oxi hóa Al của oxi.
* Một số hợp chất quan trọng
1. Nhôm oxit: Al2O3
- Tính chất vật lý
+ Màu trắng, bền với nhiệt, không nóng chảy.
+ Không tác dụng với nước, không tan trong nước.
- Tính chất hóa học
+ Là oxit lưỡng tính: phản ứng với kiềm nóng chảy và dung dịch axit:
Al2O3 + 2NaOH + 3H2O → Na[(Al(OH)4]
Al2O3 + 6HCl → 2AlCl3 + 3H2O
+ Vì rất bền nên Al2O3 rất khó bị khử thành kim loại: Khử Al2O3 bằng C không cho Al mà thu được Al4C3:
Al2O3 + 9C → Al4C3 + 6CO
+ Al2O3 không tác dụng với H2, CO ở bất kì nhiệt độ nào.
- Ứng dụng:
+ Điều chế đá quý nhân tạo.
+ Tinh thể Al2O3 còn được dùng để chế tạo các chi tiết trong các ngành kĩ thuật chính xác như chân kính đồng hồ, thiết bị phát tia laze,...
+ Bột Al2O3 có độ cứng cao (emeri) được dùng làm vật liệu mài.
+ Phần chủ yếu nhôm oxit được dùng để điều chế nhôm.
+ Ngoài ra, Al2O3 còn được dùng làm vật liệu chịu lửa: chén nung, ống nung và lớp lót trong các lò điện. Nhôm oxit tinh khiết còn được dùng làm ximăng tram răng.
- Điều chế: Trong công nghiệp, Al2O3 được điều chế bằng cách nung Al(OH)3- ở nhiệt độ cao 1200 - 1400oC:
2Al(OH)3 → Al2O3 + 3H2O
2. Nhôm hydroxit: Al(OH)3
- Tính chất vật lý
+ Là hợp chất màu trắng, kết tủa keo, không tan trong nước, không bền nhiệt.
- Tính chất hóa học
+ Dễ bị nhiệt phân thành nhôm oxit:
2Al(OH)3 −tº, xt→) Al2O3 + 3H2O
+ Là hợp chất lưỡng tính, tan trong axit và bazo:
Al(OH)3 + 3H+ → Al3+ + 3H2O
Al(OH)3 + OH- → [(Al(OH)4]-
- Điều chế
Cho muối Al3+ phản ứng với dung dịch NH3 hoặc muối Na2CO3
Al3+ + 3NH3 + 3H2O → Al(OH)3 + 3NH4+
2AlCl3 + 3Na2CO3 + 3H2O → 2Al(OH)3 ↓ + 6NaCl + 3CO2 ↑
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Cơ bản - phần 1)
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Cơ bản - phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 1)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 3)
- Lý thuyết Kim loại kiềm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
- Lý thuyết Kim loại kiềm thổ: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng
Trên đây VnDoc đã giới thiệu tới các bạn Lý thuyết Nhôm: Tính chất hóa học, Tính chất vật lí, Điều chế, Ứng dụng. Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








