100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 3)
Câu hỏi trắc nghiệm Đại cương về kim loại có đáp án
Chuyên đề Hóa học 12 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 3). Chắc chắn tài liệu sẽ giúp các bạn học sinh giải bài tập Hóa học lớp 12 hiệu quả hơn. Mời các bạn tham khảo.
Câu 71: Cho a mol AlCl3 vào 1 lít dung dịch NaOH có nồng độ b M được 0,05 mol kết tủa, thêm tiếp 1 lít dung dịch NaOH trên thì được 0,06 mol kết tủa. Giá trị của a và b lần lượt là
A. 0,15 và 0,06.
B. 0,09 và 0,18.
C. 0,09 và 0,15.
D. 0,06 và 0,15.
a mol AlCl3 + 1 lit dd NaOH b M → 0,05 mol kết tủa Al(OH)3 (1)
Thêm tiếp 1 lit dd NaOH trên → 0,06 mol kết tủa (2)
Chứng tỏ ở thí nghiệm (1) AlCl3 chưa tác dụng hết, NaOH tác dụng hết.
TN1: nNaOH = b mol
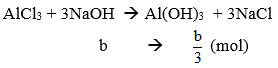
Mà nAl(OH)3↓ = 0,05 mol → b/c = 0,05 ⇔ b = 0,15 mol hay CM(NaOH) = b = 0,15 M.
TN2: nNaOH = b + b = 2b = 0,3 mol
∗ Nếu AlCl3 chưa kết tủa hết thì NaOH phải hết và tạo ra 0,06 mol kết tủa, thực tế:
nNaOH pư = 0,18 mol < 0,3 mol → Vô lí → Loại
→ AlCl3 đã tác dụng hết tạo kết tủa và kết tủa bị hòa tan một phần:

→ a – (0,3 – 3a) = 0,06 → a = 0,09 mol
→ Đáp án C
Câu 72: X là dung dịch chứa 0,1 mol AlCl3, Y là dung dịch chứa 0,32 mol NaOH. Thực hiện 2 thí nghiệm sau:
- Thí nghiệm 1: Cho từ từ Y vào X, sau khi cho hết Y vào X được a gam kết tủa.
- Thí nghiệm 2: Cho từ từ X vào Y, sau khi cho hết X vào Y được b gam kết tủa.
Nhận định nào sau đây là đúng?
A. a = b = 3,12.
B. a = b = 6,24.
C. a = 3,12, b = 6,24.
D. a = 6,24, b = 3,12.
TN1: Cho Y vào X.
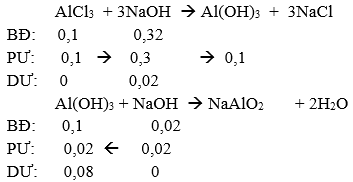
→nAl(OH)3↓ = 0,08 mol → mAl(OH)3↓ = 0,08.78 = 6,24 gam → a = 6,24 gam
TN2: Cho X vào Y.
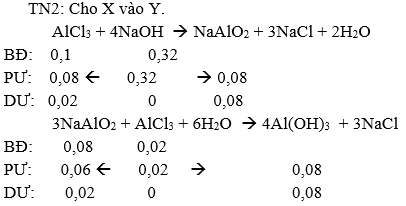
→nAl(OH)3↓ = 0,08 mol → mAl(OH)3↓ = 0,08.78 = 6,24 gam → b = 6,24 gam
→ a = b = 6,24 gam.
→ Đáp án B
Câu 73: X là dung dịch AlCl3, Y là dung dịch NaOH 2M. Cho 150 ml dung dịch Y vào cốc chứa 100 ml dung dịch X, khuấy đều tới phản ứng hoàn toàn thấy trong cốc có 7,8 gam kết tủa. Thêm tiếp vào cốc 100 ml dung dịch Y, khuấy đều đến khi kết tủa phản ứng thấy trong cốc có 10,92 gam kết tủa. Nồng độ mol của dung dịch X là
A. 3,2M.
B. 2,0M.
C. 1,6M.
D. 1,0M.
TN1: 150 ml dd Y (NaOH 2M) vào 100 ml dd X (AlCl3) → 7,8 gam kết tủa Al(OH)3
TN2: Thêm tiếp vào cốc trên 100 ml dd Y → 10,92 gam kết tủa Al(OH)3
nNaOH (1) = 0,15.2 = 0,3 mol, n↓(1) = 7,8/78 = 0,1 mol
nNaOH (2) = 0,1.2 = 0,2 mol, n↓(2) = 10,92/78 = 0,1 mol
Gọi nồng độ của AlCl3 là a M.
Theo đề bài khi cho nNaOH = nNaOH (1) + nNaOH (2) = 0,3 + 0,2 = 0,5 mol vào 0,1a mol AlCl3 thì thu được 0,14 mol kết tủa Al(OH)3.
Vì 3nAl(OH)3 < nNaOH → xảy ra sự hòa tan kết tủa.
Khi đó 4nAlCl3 = nNaOH + nAl(OH)3 ⇔ 0,4a = 0,5 + 0,14 ⇔ a = 1,6 M.
→ Đáp án C
Câu 74: Chia m gam hỗn hợp Na2O và Al2O3 thành 2 phần bằng nhau:
- Phần 1: Hoà tan trong nước dư thu được 1,02 gam chất rắn không tan.
- Phần 2: Hoà tan vừa hết trong 140 ml dung dịch HCl 1M. Giá trị của m là
A. 2,26.
B. 2,66.
C. 5,32.
D. 7,0.
Gọi số mol của Na2O và Al2O3 trong một phần là x và y mol.
Phần 1:
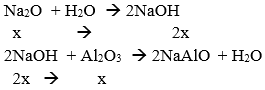
→ Chất rắn không tan là Al2O3 → y – x = 1,02/102 = 0,01 (1)
Phần 2:
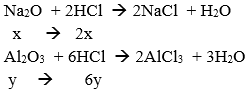
Theo bài ta có: 2x + 6y = 0,14.1 = 0,14 → x + 3y = 0,07 (2)
Từ (1) và (2) ta có: x = 0,01 mol; y = 0,02 mol
→ m = 2(0,01.62 + 0,02.102) = 5,32 gam.
→ Đáp án C
Câu 75: Hoà tan hết hỗn hợp gồm một kim loại kiềm và một kim loại kiềm thổ trong nước được dung dịch A và có 1,12 lít H2 bay ra (ở đktc). Cho dung dịch chứa 0,03 mol AlCl3 vào dung dịch A. Khối lượng kết tủa thu được là
A. 0,78 gam.
B. 0,81 gam.
C. 1,56 gam.
D. 2,34 gam
Ta có nhận xét:
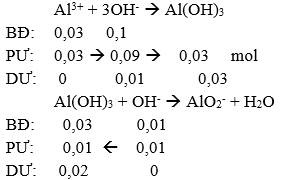
→ mAl(OH)3 ↓ = 0,02.78 = 1,56 gam.
→ Đáp án C
Câu 76: Hòa tan hết 15,0 gam hỗn hợp X gồm Fe, Fe3O4, FeCO3 và Fe(NO3)2 trong dung dịch chứa NaHSO4 và 0,16 mol HNO3 thu được dung dịch Y và hỗn hợp khí Z gồm CO2 và NO (tỉ lệ mol tương ứng 1 : 4). Dung dịch Y hòa tan tối đa 8,64 gam bột Cu, thấy thoát ra 0,03 mol khí NO. Nếu cho dung dịch Ba(OH)2 dư vào Y, thu được 154,4 gam kết tủa. Biết các phản ứng xảy ra hoàn toàn và khí NO là sản phẩm khử duy nhất của cả quá trình. Phần trăm khối lượng của Fe đơn chất trong hỗn hợp X là:
A. 48,80%
B. 33,60%
C. 37,33%
D. 29,87%
Cu + Y → sinh ra NO ⇒ chứa H+ và NO3- không chứa Fe2+
Ta có sơ đồ phản ứng:
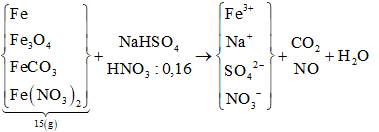
nH+ du = 4nNO = 0,12 mol
Bảo toàn e: 2nCu = nFe3+ + 3nNO ⇒ nFe3+ = 0,18 mol
Xét Ba(OH)2 + Y ⇒ ↓ gồm Fe(OH)3 và BaSO4 → nBaSO4 = 0,58 mol
Bảo toàn gốc SO4: nNaHSO4 = nSO42-/Y = nBaSO4 = 0,58 mol ⇒ nNa+/Y
Bảo toàn điện tích: nNO3- = 0,18 mol
Bảo toàn nguyên tố Hidro: nH2O = 0,31 mol
Bảo toàn khối lượng: mZ = 4,92 (g) → dễ giải ra được 0,03 mol CO2; 0,12 mol NO
Bảo toàn nguyên tố Nito: nFe(NO3)2 = 0,02 mol; nFeCO3 = nCO2 = 0,03 mol
nH+ pư = 2nO + 4nNO + 2nCO3 ⇒ nO = 0,04 mol ⇒ nFe3O4 = 0,01 mol
Bảo toàn nguyên tố Fe: nFe = 0,1 mol ⇒ %mFe = (0,1.56) : (15.100%) = 37,33%
→ Đáp án C
Câu 77: X là hỗn hợp gồm Mg và MgO (trong đó Mg chiếm 60% khối lượng). Y là dung dịch gồm H2SO4 và NaNO3. Cho 6 gam X tan hoàn toàn vào Y, thu được dung dịch Z (chỉ chứa ba muối trung hòa) và hỗn hợp hai khí (gồm khí NO và 0,04 mol H2). Cho dung dịch BaCl2 dư vào Z, thu được m gam kết tủa. Biết Z có khả năng tác dụng vừa đủ với dung dịch chứa 0,44 mol NaOH. Giá trị của m T là
A. 55,92.
B. 25,2.
C. 46,5.
D. 53,6.
Có 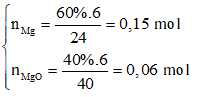
Khí thu được có H2 ⇒ Chứng tỏ NO3- phản ứng hết.
Z chỉ chứa 3 muối trung hòa là: ZnSO4 (0,21 mol), Na2SO4, (NH4)2SO4.
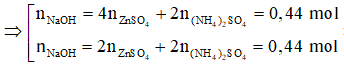
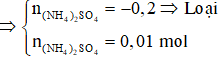
-BT e→ 2.0,15 = 16.0,01 + 3nNO + 2.0,04 ⇒ nNO = 0,02 mol
-BTNT N→ nNaNO3 = 2.0,01 + 0,02 = 0,04 mol
-BTĐT→ nSO42- = (2.0,21 + 2.0,01 + 0,04)/2 = 0,24 mol ⇒ m = 233.0,24 = 55,29g
→ Đáp án A
Câu 78: Bảng dưới đây ghi lại hiện tượng khi làm thí nghiệm với các chất sau ở dạng dung dịch nước: X, Y, Z và T:
| Chất | ||||
| Cách làm | X | Y | Z | T |
| Thí nghiệm 1: Thêm dung dịch NaOH (dư) | Có kết tủa sau đó tan dần | Có kết tủa sau đó tan dần | Có kết tủa không tan | Không có kết tủa |
| Thí nghiệm 2: Thêm tiếp nước brom vào các dung dịch thu được ở thí nghiệm 1 | Không có hiện tượng | Dung dịch chuyển sang màu vàng | Không có hiện tượng | Không có hiện tượng |
Các chất X, Y, Z và T lần lượt là
A. MgCl2, CrCl3, AlCl3, KCl
B. CrCl3, AlCl3, MgCl2, KCl
C. CrCl3, MgCl2, KCl, AlCl3
D. AlCl3, CrCl3, MgCl2, KCl.
X là AlCl3 do kết tủa tạo ra là Al(OH)3 sau đó bị kiềm hoà tan tạo NaAlO2. NaAlO2 không tác dụng với nước brom.
Y là CrCl3 vì tạo kết tủa Cr(OH)3, kết tủa này tan tạo NaCrO2. NaCrO2 tác dụng với nước brom tạo Na2CrO4màu vàng.
T phải là KCl vì nó không phản ứng ở 2 thí nghiệm.
Vậy Z là MgCl2.
→ Đáp án D
Câu 79: Hình vẽ sau do một học sinh vẽ để mô tả lại thí nghiệm ăn mòn điện hóa học khi cắm hai lá Cu và Zn (được nối với nhau bằng một dây dẫn) vào dung dịch H2SO4 loãng
Trong hình vẽ bên chi tiết nào chưa đúng?
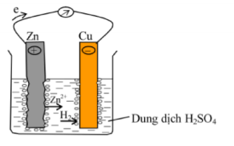
A. Bề mặt hai thanh Cu và Zn.
B. Chiều dịch chuyển của electron trong dây dẫn.
C. Ký hiệu các điện cực.
D. Hiện tượng xảy ra trên điện cực Zn.
A, B, D đúng. C sai vì do Zn ở cực âm, Cu ở cực dương
→ Đáp án C
Câu 80: Tiến hành các thí nghiệm sau:
(a) Cho Mg vào dung dịch Fe2(SO4)3 dư.
(b) Sục khí Cl2 vào dung dịch FeCl2.
(c) Dẫn khí H2 dư qua bột CuO nung nóng.
(d) Cho Na vào dunh dịch CuSO4 dư.
(e) Nhiệt phân AgNO3.
(g) Đốt FeS2 trong không khí.
(h) Điện phân dung dịch CuSO4 với điện cực trơ.
Sau khi kết thúc các pahrn ứng, số thí nghiệm thu được kim loại là
A. 5.
B. 3.
C. 4.
D. 2.
(a) Mg + Fe2(SO4)3 dư → MgSO4 + 2FeSO4
(b) Cl2 + 2FeCl2 → 2FeCl3
(c) H2 + CuO -to→ Cu + H2O
(d) 2Na + 2H2O → 2NaOH + H2↑
CuSO4 + 2NaOH → Na2SO4 + Cu(OH)2↓
(e) 2AgNO3 -to→ 2Ag + 2NO2 + O2
(g) 4FeS2 + 11O2 -to→ 2Fe2O3 + 8SO2↑
(h) 2CuSO4 + 2H2O -dpdd→ 2Cu↓ + 2H2SO4 + O2↑
→ Có 3 thí nghiệm thu được kim loại là (c), (e), (h)
→ Đáp án B
Câu 81: Thực hiện các thí nghiệm sau:
(1) Cho kim loại Fe nguyên chất vào dung dịch CuSO4.
(2) Cho lá kim loại Al nguyên chất vào dung dịch HNO3 đặc, nguội.
(3) Đốt dây kim loại Mg nguyên chất trong khí Cl2.
(4) Cho lá hợp kim Fe - Cu vào dung dịch H2SO4 loãng.
Số thí nghiệm xảy ra phản ứng ăn mòn kim loại là
A. 1.
B. 4.
C. 2.
D. 3.
(1) Thỏa mãn: ban đầu Fe bị ăn mòn hóa học: Fe + CuSO4 → FeSO4 + Cu↓.
Cu sinh ra bám trực tiếp lên Fe ⇒ xảy ra ăn mòn điện hóa đồng thời với ăn mòn hóa học.
(2) Không thỏa vì Al bị thụ động trong HNO3 đặc, nguội.
(3) Thỏa mãn vì Mg + Cl2 -to→ MgCl2.
(4) Thỏa mãn vì Fe bị ăn mòn điện hóa.
⇒ chỉ có (2) không thỏa ⇒ chọn D.
→ Đáp án D
Câu 82: Cho các cặp chất với tỉ lệ số mol tương ứng như sau:
(a) Fe3O4 và Cu (1:1)
(b) Na và Zn (1:1)
(c) Zn và Cu (1:1)
(d) Fe2(SO4)3 và Cu (1:1)
(e) FeCl2 và Cu (2:1)
(g) FeCl3 và Cu (1:1)
Số cặp chất tan hoàn toàn trong một lượng dư dung dịch HCl loãng nóng là
A. 2
B. 5
C. 3
D. 4
Xét từng thí nghiệm:
(a) Fe3O4 + 8HCl → FeCl2 + 2FeCl3 + 4H2O
Cu + 2FeCl3 → CuCl2 + 2FeCl2
Với tỉ lệ 1 : 1, thì hh Fe3O4 và Cu tan hết trong dd HCl loãng, nóng dư.
(b) Na + H2O → NaOH + 1/2H2
Zn + 2NaOH → Na2ZnO2 + H2
Zn + 2HCl → ZnCl2 + H2
(c) Zn + 2HCl → ZnCl2 + H2
Cu không tan trong muối và HCl
(d) Fe2(SO4)3 + Cu → 2FeSO4 + CuSO4
Tỉ lệ 1:1, các chất tan hết trong dd HCl
(e) Cu không tan trong HCl và FeCl2
(g) 2FeCl3 + Cu → 2FeCl2 + CuCl2
1 mol → 0,5 mol còn dư 0,5 mol Cu không tan trong HCl.
Vậy các thí nghiệm thỏa mãn: a), b), d).
→ Đáp án C
Câu 83: Cho 24,3 gam bột Al vào 225 ml dung dịch hỗn hợp NaNO3 1M và NaOH 3M khuấy đều cho đến khi khí ngừng thoát ra thì dừng lại và thu được V lít khí (ở đktc). Giá trị của V là:
A. 11,76 lít
B. 9,072 lít
C. 13,44 lít
D. 15,12 lít
nAl = 24,3/27 = 0,9 mol, nNaNO3 = 1.0,225 = 0,225 mol, nNaOH = 3.0,225 = 0,675 mol
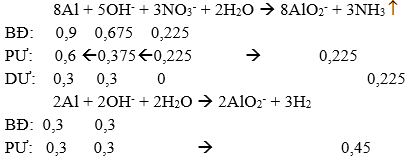
→ V = (0,225 + 0,45).22,4 = 15,12 lit
→ Đáp án D
Câu 84: Hòa tan 12,8 gam bột Cu trong 200 ml dung dịch hỗn hợp KNO3 0,5M và H2SO4 1M. Thể tích khí NO (sản phẩm khử duy nhất) thoát ra ở đktc là
A. 2,24 lít.
B. 2,99 lít.
C. 4,48 lít.
D. 11,2 lít.
nCu = 12,8/64 = 0,2 mol, nKNO3 = 0,5.0,2 = 0,1 mol, nH2SO4 = 1.0,2 = 0,2 mol
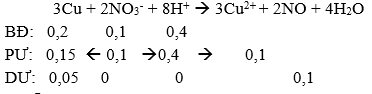
⇒ VNO = 0,1.22,4 = 2,24 lit
→ Đáp án A
Câu 85: Hòa tan m gam bột Al vào lượng dư dung dịch hỗn hợp của NaOH và NaNO3 thấy xuất hiện 6,72 lít (đkc) hỗn hợp khí NH3 và H2 với số mol bằng nhau. Khối lượng m bằng:
A. 6,72 gam.
B. 7,59 gam.
C. 8,10 gam.
D. 13,50 gam.
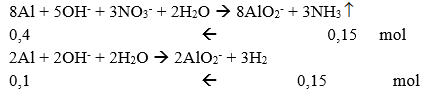
→ mAl = (0,1 + 0,4).27 = 13,5 gam
→ Đáp án D
Câu 86: Cho hỗn hợp gồm 1,12 gam Fe và 1,92 gam Cu vào 400 ml dung dịch chứa hỗn hợp gồm H2SO4 0,5M và NaNO3 0,2M. Sau khi các phản ứng xảy ra hoàn toàn, thu được dung dịch X và khí NO (sản phẩm khử duy nhất). Cho V ml dung dịch NaOH 1M vào dung dịch X thì lượng kết tủa thu được là lớn nhất. Giá trị tối thiểu của V là:
A. 360 ml
B. 240 ml
C. 400 ml
D. 120 ml
nFe = 0,02 mol; nCu = 0,03 mol
→ ∑ ne cho = 0,02.3 + 0,03.2 = 0,12 mol ;
nH+ = 0,4 mol; nNO3- = 0,08 mol (Ion NO3- trong môi trường H+ có tính oxi hóa mạnh như HNO3)
- Bán phản ứng: 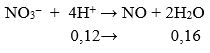
Do ![]() → kim loại hết và H+ dư
→ kim loại hết và H+ dư
→ nH+ dư = 0,4 – 0,16 = 0,24 mol
→ ∑ nOH- (tạo kết tủa max) = 0,24 + 0,02.3 + 0,03.2 = 0,36
→ V = 0,36 lít hay 360 ml
→ Đáp án A
Câu 87: Đem điện phân 200ml dung dịch NaCl 2M (d = 1,1g/ml) với điện cực bằng than có màng ngăn xốp và dung dịch luôn luôn được khuấy đều. Khí ở catot thoát ra 22,4 lít khí đo ở điều kiện tiêu chuẩn thì ngừng điện phân. Cho biết nồng độ phần trăm của dung dịch NaOH sau điện phân:
A. 8,38 %
B. 54,42%
C. 16,64%
D. 8,32%
mdung dịch = 200.1,1 = 220 (g); nNaOH = nNaCl = 0,2.2 = 0,4 (mol)
dễ thấy khí thoát ra ở catot là H2 với nH2 = 1 (mol)
Phương trình điện phân: NaCl + H2O → NaOH + 1/2 H2 + 1/2 Cl2
Thấy nH2 = 0,2 mol < 1 mol nên H2O điện phân
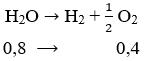
mdung dịch sau phản ứng = 220 – (1.2 + 0,4.32 + 0,2.71) = 191 (g)
nên C% (NaOH) = [(0,4.40)/191]. 100% = 8,38%
→ Đáp án A
Câu 88: Tiến hành điện phân (với điện cực Pt) 200 gam dung dịch NaOH 10 % đến khi dung dịch NaOH trong bình có nồng độ 25 % thì ngừng điện phân. Thể tích khí (ở đktc) thoát ra ở anot và catot lần lượt là:
A. 149,3 lít và 74,7 lít
B. 156,8 lít và 78,4 lít
C. 78,4 lít và 156,8 lít
D. 74,7 lít và 149,3 lít
mNaOH (trước điện phân) = (200.10)/100 = 20 (gam).
Điện phân dung dịch NaOH thực chất là điện phân nước:
H2O → 1/2 O2 (anot) + H2 (catot) → NaOH không đổi
Dung dịch NaOH trong bình có nồng độ 25 % thì ngừng điện phân
⇒ mdung dịch sau điện phân = 20:25% = 80 (gam)
⇒ mnước bị điện phân = 200 – 80 = 120 (gam)
⇒ nnước = 120/18 = 20/3 mol → Voxi = (20/3). (1/2). 22,4 = 74,7 lít và VH = (20/3).22,4 = 149,3 lít.
→ Đáp án D
Câu 89: Sau một thời gian điện phân 200 ml dung dịch CuSO4 (d = 1,25 g/ml) với điện cực graphit (than chì) thấy khối lượng dung dịch giảm 8 gam. Để làm kết tủa hết ion Cu2+ còn lại trong dung dịch sau điện phân cần dùng 100 ml dung dịch H2S 0,5 M. Nồng độ phần trăm của dung dịch CuSO4 ban đầu là:
A. 12,8 %
B. 9,6 %
C. 10,6 %
D. 11,8 %
Số mol của H2S bằng 0,5.(100/1000) = 0,05 (mol)
Gọi x là số mol CuSO4 tham gia quá trình điện phân:
CuSO4 + H2O → Cu + 1/2 O2 + H2SO4 (1)
mdung dịch giảm = mCu(catot) + moxi(anot) = 64x + 16x = 8 ⇒ x = 0,1 (mol)
CuSO4 + H2S → CuS + H2SO4 (2)
⇒ nH2S = nCuSO4 = 0,05 (mol)
Từ (1) và (2) → số mol CuSO4 (ban đầu) bằng: 0,1 + 0,05 = 0,15 (mol)
Nồng độ phần trăm của dung dịch CuSO4 ban đầu bằng:
→ Đáp án B
Câu 90: Điện phân hòa toàn 2,22 gam muối clorua kim loại ở trạng thái nóng chảy thu được 448 ml khí (ở đktc) ở anot. Kim loại trong muối là:
A. Na
B. Ca
C. K
D. Mg
Khí thoát ra ở anot chính là Clo với số mol bằng: nClo = 0,02 (mol)
Tại catot: Mn+ + ne → M
Theo định luật bảo toàn khối lượng mM = mmuối – mClo = 2,22 – 0,02.71 = 0,8 (gam)
Tại anot: 2Cl- → Cl2 + 2e
Theo định luật bảo toàn e ta có nM = 0,4/n ⇒ M = 20.n ⇒ n = 2 và M là Ca.
(hoặc có thể viết phương trình điện phân MCln -đpnc→ M + n/2 Cl2 để tính)
→ Đáp án B
Câu 91: Cho các phát biểu sau:
(a) Cấu hình electron của kim loại kiềm là những nguyên tố s
(b) Các kim loại kiềm có cấu trúc mạng tinh thể lập phương tâm khối.
(c) Các kim loại kiềm mềm do liên kết kim loại trong tinh thể yếu
(d) Ứng dụng kim loại xexi dùng làm tế bào quang điện
(e) Phương pháp thường dùng để điều chế kim loại kiềm là điện phân nóng chảy muối halogenua của kim loại kiềm.
Số phát biểu đúng là:
A. 5
B. 2
C. 4
D. 3
Cả 5 phát biểu đều đúng.
→ Đáp án A
Câu 92: So sánh độ dẫn điện của hai dây dẫn bằng đồng tinh khiết, có khối lượng bằng nhau. Dây thứ nhất chỉ có một sợi. Dây thứ hai gồm một bó hàng trăm sợi nhỏ. Độ dẫn điện của hai dây dẫn là
A. không so sánh được.
B. dây thứ hai dẫn điện tốt hơn.
C. dây thứ nhất dẫn điện tốt hơn.
D. bằng nhau.
R = ρ/S với R là điện trở, S là tiết diện ngang, l là chiều dài của khối vật dẫn, ρ là điện trở suất của chất.
Do không cho chiều dài của 2 dây ⇒ không thể so sánh được độ dẫn điện ⇒ chọn A.
→ Đáp án A
Câu 93: Kim loại nào sau đây phản ứng được với cả hai dung dịch là dung dịch FeSO4 và dung dịch H2SO4 đặc, nguội?
A. Na.
B. Al.
C. Fe.
D. Cu.
+ Al, Fe bị thụ động với dung dịch H2SO4 đặc, nguội → B, C sai.
+ Cu không phản ứng với dung dịch FeSO4 (ngược quy tắc α) → D sai.
+ Na phản ứng được với cả 2 dung dịch có thể theo các phản ứng sau:
2Na + 2H2O + FeSO4 → Fe(OH)2 + H2 + Na2SO4
8Na + 5H2SO4 đặc → 4Na2SO4 + H2S + 4H2O
(Có thể có sản phẩm khử khác như SO2, S tùy vào điều kiện phản ứng và sau khi H2SO4 hết có thể Na tiếp tục phản ứng với H2O)
→ Đáp án A
Câu 94: Cho các phát biểu sau:
(1) Các oxit của kim loại kiềm phản ứng với CO tạo thành kim loại.
(2) Các kim loại Ag, Fe, Cu và Mg đều được điều chế được bằng phương pháp điện phân dung dịch.
(3) Các kim loại Mg, K và Fe đều khử được ion Ag+ trong dung dịch thành Ag.
(4) Cho Cu vào dung dịch FeCl3 dư, thu được dung dịch chứa 3 muối.
Số phát biểu đúng là
A. 4.
B. 1.
C. 3.
D. 2.
+ Các oxit của kim loại kiềm đứng trước Al không bị khử bởi CO → 1 sai
+ Mg chỉ được điều chế bằng phương pháp điện phân nóng chảy → 2 sai
+ K không khử ion Ag+ thành Ag mà khử nước → 3 sai
+ Cho Cu vào dung dịch FeCl3 dư thì xảy ra phản ứng: Cu + 2FeCl3 → CuCl2 + 2FeCl2
→ thu được 3 muối: CuCl2, FeCl2 và FeCl3 dư → 4 đúng
→ Đáp án B
Câu 95: Dẫn khí CO (dư) đi qua hỗn hợp gồm Al2O3, FeO, CuO ở nhiệt độ cao đến phản ứng hoàn toàn thu được chất rắn X. Để hòa tan hết X có thể dùng dung dịch (loãng, dư) nào sau đây?
A. NaOH.
B. Fe2(SO4)3.
C. H2SO4.
D. HNO3.
CO chỉ khử được các oxit kim loại sau Al → Rắn X là Al2O3, Fe, Cu.
+ Dùng dung dịch NaOH chỉ hòa tan được Al theo phản ứng: 2Al + 2NaOH + 2H2O → NaAlO2 + 3H2
+ Dùng dung dịch Fe2(SO4)3 chỉ hòa tan được Fe và Cu theo các phản ứng:
Fe2(SO4)3 + Fe → 3FeSO4
Fe2(SO4)3 + Cu → 2FeSO4 + CuSO4
+ Dùng H2SO4 loãng chỉ hòa tan được Al2O3 và Fe theo các phản ứng:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
+ Dùng dung dịch HNO3 loãng có thể hòa tan hoàn toàn rắn X theo các phản ứng:
Al2O3 + 6HNO3 → 2Al(NO3)3 + 3H2O
Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
→ Đáp án D
Câu 96: Khi không có không khí, hai kim loại nào sau đây đều tác dụng với HCl trong dung dịch theo cùng tỉ lệ số mol?
A. Na và Mg.
B. Fe và Al.
C. Na và Zn.
D. Fe và Mg.
Phản ứng của Fe và Mg với HCl có cùng tỉ lệ mol kim loại/HCl là 1/2, cụ thể:
Fe + 2HCl → FeCl2 + H2
Mg + 2HCl → MgCl2 + H2
→ Đáp án D
Câu 97: Điện phân dung dịch NaCl có màng ngăn. Nhận xét nào sau đây là đúng?
A. Ở catot xảy ra sự khử ion kim loại Natri.
B. Ở anot xảy ra sự oxi hóa H2O.
C. Ở anot sinh ra khí H2.
D. Ở catot xảy ra sự khử nước.
Do ion Na+ không bị điện phân trong dung dịch ⇒ tại catot chỉ xảy ra sự khử H2O.
→ Đáp án D
Câu 98: Cho các phát biểu sau
(1) Các kim loại Fe, Ni, Zn đều có thể điều chế bằng phương pháp điện phân dung dịch muối của nó.
(2) Trong dung dịch Na, Fe đều khử được AgNO3 thành Ag.
(3) Cho Fe vào dung dịch FeCl3 dư sau phản ứng thu được dung dịch chứa hai muối.
(4) Hỗn hợp Na và Al có thể tan hoàn toàn trong nước.
(5) Tính oxi hóa của Ag+ > Fe3+ > Cu2+ > Fe2+.
Tổng số phát biểu đúng là
A. 2.
B. 3.
C. 4.
D. 5.
(1) Đúng vì các kim loại sau Al trong dãy điện hóa đều có thể điều chế bằng phương pháp điện phân dung dịch.
(2) Sai vì Na không khử được AgNO3 do tác dụng với H2O trước.
(3) Đúng vì: Fe + 2FeCl3 → 3FeCl2 ⇒ dung dịch chứa 2 muối là FeCl2 và FeCl3 dư.
(4) Đúng vì nếu với tỉ lệ thích hợp thì: 2Na + 2H2O → 2NaOH + H2↑; 2NaOH + 2Al + 2H2O → 2NaAlO2 + 3H2↑.
(5) Đúng.
⇒ chỉ có (2) sai
→ Đáp án C
Câu 99: Cho thứ tự trong dãy điện hóa của một cặp oxi hóa- khử như sau Al3+/Al; Zn2+/Zn; Fe2+/Fe; Pb2+/Pb; Ag+/Ag. Phát biểu nào sau đây là đúng?
A. Nguyên tử Pb có thể khử Zn2+ trong dung dịch.
B. Nguyên tử Ag có thể khử Zn2+ trong dung dịch.
C. Nguyên tử Fe có thể khử Zn2+ trong dung dịch.
D. Nguyên tử Al có thể khử Zn2+ trong dung dịch.
Dựa vào dãy điện hóa, kim loại đứng trước (từ Al) có thể đẩy kim loại đứng sau ra khỏi muối của nó.
→ Đáp án D
Câu 100: Có 5 kim loại là Mg, Ba, Zn, Fe, Ag. Chỉ dùng thêm dung dịch H2SO4 loãng thì có thể nhận biết được các kim loại
A. Mg, Ba, Zn, Fe
B. Mg, Ba, Zn, Fe, Ag
C. Mg, Ba, Zn
D. Mg, Ba, Cu
Dùng H2SO4 loãng:
+) Kết tủa + bọt khí: Ba
+) Kết tủa: Ag
+) Tan + bọt khí: Mg, Zn, Fe
Cho Ba dư vào 3 bình chưa nhận được
+) Kết tủa trắng hóa nâu khoài không khí ⇒ Fe
+) Kết tủa trắng: Mg và Zn
Cho Ba dư vào dung dịch H2SO4 ⇒ lọc kết tủa ⇒ chỉ còn dung dịch Ba(OH)2
Cho 2 kim loại chưa nhận được vào:
+) Kim loại tan + khí : Zn
+) kết tủa: Mg
→ Đáp án B
Mời các bạn tham khảo thêm các bài viết dưới đây của chúng tôi:
- Kim loại tác dụng với dung dịch axit
- Kim loại tác dụng với dung dịch muối
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Cơ bản - phần 1)
- 80 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Cơ bản - phần 2)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 1)
- 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 2)
Trên đây VnDoc đã giới thiệu tới các bạn 100 câu trắc nghiệm Đại cương về kim loại có lời giải chi tiết (Nâng cao - phần 3). Để có kết quả cao hơn trong học tập, VnDoc xin giới thiệu tới các bạn học sinh tài liệu Giải bài tập Toán lớp 12, Giải bài tập Hóa học lớp 12, Giải bài tập Vật Lí 12, Tài liệu học tập lớp 12 mà VnDoc tổng hợp và đăng tải.








